Nung 1,32 a (g) hỗn hợp Mg(OH)2 và Fe(OH)2 trong không khí đến khối lượng không đổi nhận được một chất rắn có khối lượng bằng a (g).Tính % mỗi oxit tạo ra.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTHH: Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Gọi số mol của Mg(OH)2 là x , số mol của Fe(OH)2 là y => Số mol của MgO là a , số mol của FeO là b
Ta có hệ phương trình sau:
- 58x + 90y = 1,32a (1)
- 40x + 72y = a (2)
Nhân phương trình (2) với 1,32 ta có :
52,8x + 95,04y = 1,32a (3)
Vì phương trình (3) và phương trình (1) đều bằng 1,32a
=> 58x + 90y = 52,8x + 95,04y
=> x = 0,97y
%MgO trong hỗn hợp oxit là:
\( {40x\ \over40x + 72y}\) . 100% = \( {40.0,97y \over 40.0,97y+72y}\) .100% = 35,02%
%FeO trong hỗn hợp oxit là:
100% - 35,02% = 64,98%

PTHH: Mg(OH)2 =(nhiệt)==> MgO + H2O
x x
4Fe(OH)2 + O2 =(nhiệt)==> 2Fe2O3 + 4H2O
y 0,25y 0,5y
Gọi số mol của Mg(OH)2, Fe(OH)2 lần lượt là x, y
Lập các số mol theo phương trình và theo đề ra ta có hệ phương trình sau:
\(\begin{cases}58x+90y=1,32a\\40x+80y=a\end{cases}\)
Giải phương trình ta đc \(\begin{cases}x=0,015a\\y=0,005a\end{cases}\)
=> %mMgO =\(\frac{0,015a.40}{a}\) x 100% = 60%
=>%mFe2O3 = 100% - 60% = 40%
Chúc bạn hoc tốt!!!

PTHH:
\(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
x....................x
\(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
y...................................0,5y
Gọi số mol Mg(OH)2, Fe(OH)2 lần lượt là x, y (mol)
Theo đề ra, ta có:
\(\begin{cases}58x+90y=1,32a\\40x+80y=a\end{cases}\)
\(\Rightarrow\begin{cases}x=0,015a\\y=0,005a\end{cases}\)
=> mMgO = 0,015a x 40 = 0,6a (gam)
=> %mMgO = \(\frac{0,6a}{a}.100\%=60\%\)
=> %mFe2O3 = 100% - 60% = 40%
PTHH: Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Gọi số mol của Mg(OH)2 là x , số mol của Fe(OH)2 là y => Số mol của MgO là a , số mol của FeO là b
Ta có hệ phương trình sau:
- 58x + 90y = 1,32a (1)
- 40x + 72y = a (2)
Nhân phương trình (2) với 1,32 ta có :
52,8x + 95,04y = 1,32a (3)
Vì phương trình (3) và phương trình (1) đều bằng 1,32a
=> 58x + 90y = 52,8x + 95,04y
=> x = 0,97y
%MgO trong hỗn hợp oxit là:
40x/40x+72y.100%=40.0,97y/40.0,97y+72y.100%=35,02%.40x/40x+72y.100%=40.0,97y/40.0,97y+72y.100%=35,02%
%FeO trong hỗn hợp oxit là:
100% - 35,02% = 64,98%

Đáp án B
2Fe(OH)2 + ½ O2 → t 0 Fe2O3 + 2H2O
Vậy chất rắn gồm: MgO, Fe2O3

Đáp án C
Mg(OH)2 → t 0 MgO + H2O
2Fe(OH)2 + ½ O2 → t 0 Fe2O3 + 2H2O
Vậy chất rắn gồm: MgO, Fe2O3

Đáp án C
Mg(OH)2 → t o MgO + H2O
2Fe(OH)2 + 0,5O2 → t o Fe2O3 + 2H2O

Đáp án A
2Fe(OH)3 → t o Fe2O3 + 3H2O
4Fe(OH)2 + O2 → t o 2Fe2O3 + 4H2O
FeO, Fe3O4 + O2 → Fe2O3
Fe(NO3)2, Fe(NO3)3 → Fe2O3
=> chất rắn A. Fe2O3
Chú ý:
nhiệt phân trong không khí =>Các oxit sắt chuyển hết thành Fe2O3

Đáp án D
Các phản ứng xảy ra:
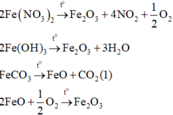
Vì sau phản ứng chỉ thu được MỘT chất rắn nên chất rắn đó phải là Fe2O3 (khi đó lượng O2 sinh ra từ phản ứng nhiệt phân Fe(NO3)2 đủ để oxi hóa hết lượng FeO sinh ra từ phản ứng (1)).
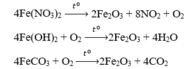
PTHH: Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Gọi số mol của Mg(OH)2 là x , số mol của Fe(OH)2 là y => Số mol của MgO là a , số mol của FeO là b
Ta có hệ phương trình sau:
Nhân phương trình (2) với 1,32 ta có :
52,8x + 95,04y = 1,32a (3)
Vì phương trình (3) và phương trình (1) đều bằng 1,32a
=> 58x + 90y = 52,8x + 95,04y
=> x = 0,97y
%MgO trong hỗn hợp oxit là:
\(\dfrac{40x}{40x+72y}.100\%=\dfrac{40.0,97y}{40.0,97y+72y}.100\%=35,02\%\)
%FeO trong hỗn hợp oxit là:
100% - 35,02% = 64,98%