khi phân tích một mẫu quặng người ta thấy có 2,8g Fe. Tính xem trong mẫu quặng đó có bao nhiêu gam Fe2O3 ứng với lượng sắt trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Phương trình hóa học:
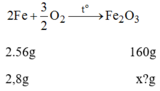
Khối lượng F e 2 O 3 ứng với lượng sắt trên là:
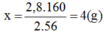
→ Chọn C.

1 mol sắt 3 oxit năng 160g chứa 112g Fe
=>với 2,8g fe thì khối lượng oxit là 2,8*160/112

\(Al_2O_3\\ n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ \Rightarrow n_O=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ m_{Al_2O_3}=0,2.27+0,3.16=10,2\left(g\right)\)

=>%mCl =100-39,3=60,7%
Đặt CTHH cần tìm là : NaxCly
=> x:y=\(\dfrac{39,3}{23}:\dfrac{60,7}{35,5}\) =1,7:1,7=1:1
=>CTHH cần tìm là : NaCl
CTHH của quặng sắt là FeS2
PTHH:
\(4FeS_2+11O_2-->2Fe_2O_3+8SO_2\)
0,05___________________0,025
\(Fe_2O_3+3H_2-->2Fe+3H_2O\)
0,025______0,075_____0,05
=>\(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\)
=>\(m_{Fe_2O_3}=0,025.160=4\left(g\right)\)
=> C
(Bạn gì đó ơi lần sau vt đề rõ hơn một chút nhé D:)

a. PTHH: 4FeS2 + 11O2 ---to---> 2Fe2O3 + 8SO2
b. Ta có: \(n_{SO_2}=\dfrac{32}{64}=0,5\left(mol\right)\)
=> \(m_{S_{\left(FeS_2\right)}}=m_{S_{\left(SO_2\right)}}=0,5.32=16\left(g\right)\)
=> \(\%_{m_{S_{\left(FeS_2\right)}}}=\dfrac{16}{20}.100\%=80\%\)
PTHH : S + O2 ------> SO2
Áp dụng định luật bảo toàn khối lượng ta có :
mS + mO2 = mSO2
=> mS= mSO2- mO2
=32-16 = 16 (g)
Thành phần % khối lượng lưu huỳnh có trong mẫu quặng đó là
%mS = 16:32.100%=50%
nFe=m/M=2,8/56=0,05(mol)
pt: 4Fe + 3O2 --t0-> 2Fe2O3
cứ: 4..........3...............2 (mol)
vậy: 0,05---------------->0,025(mol)
=> mFe2O3=n.M=0,025.160=4(g
Ta có nFe = \(\dfrac{2,8}{56}\) = 0,05 ( mol )
Fe2O3 + 3H2 → 2Fe + 3H2O
0,025......................0,05
=> mFe2O3 = 0,025 . 160 = 4 ( gam )