Làm lạnh 29g dd Fe(NO3)3 41,72% xuống 5oC thấy có 8,08g tinh thể X, phần dd còn lại có 34,7% Fe(NO3)3
a) Xđ CT của X
b) Tính độ tan của Fe(NO3)3 ở 5oC
Giúp dùm bài này với mọi người
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$n_{Fe(NO_3)_3} = \dfrac{29.41,724\%}{242} = 0,05(mol)$
$m_{dd\ sau\ tách\ tinh\ thể} = 29 - 8,08 = 20,92(gam)$
$n_{Fe(NO_3)_3\ sau\ tách\ tinh\ thể} = \dfrac{20,92.34,704\%}{242} = 0,03(mol)$
$\Rightarrow n_{Fe(NO_3)_3.nH_2O} = 0,05 - 0,03 = 0,02(mol)$
$\Rightarrow M_{Fe(NO_3)_3.nH_2O} = 242 + 18n = \dfrac{8,08}{0,02} = 404$
$\Rightarrow n = 9$
Vậy CT của tinh thể là $Fe(NO_3)_3.9H_2O$

Đáp án B
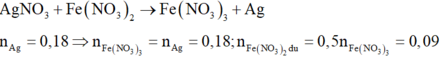
Gọi số mol Al và Mg tối đa mà dung dịch X có thể phản ứng được là x và 3x
Nên 3x + 2.3x = 0,09.2 + 0,18.3(ne cho =ne nhận)
Suy ra x = 0,08 => mAl + mMg = 7,92(g)

Khi cho tinh thể fe(NO3)3.nH2O vào nước thì thu được dung dịch là Fe(NO3)3
Ta có PTHH :
\(Fe\left(NO3\right)3+3NaOH->Fe\left(OH\right)3\downarrow+3NaNO3\)
Theo đề bài ta có : nFe(OH)3 = \(\dfrac{2,14}{107}=0,02\left(mol\right)\)
Theo PTHH ta có : nFe(NO3)3 = nFe(OH)3 = 0,02 (mol)
Mà nFe(NO3)3.nH2O = nFe(NO3)3 = 0,02 (mol)
Ta có :
mFe(NO3)3 = 0,02.242 = 4,84 (g)
=> mdd(sau p/ư) = \(\dfrac{4,48.100\%}{9,68\%}\approx46,28\left(g\right)\)
=> mdm = mdd - mct = 46,28 - 4,48 = 41,8 (g)
mH2O(trong tinh thể) = mH2O - mH2O(ban đầu)
Mà Vì 41,8 < 41,92 nên => đề sai -.-

Đáp án A
Ta có CM HNO3 = CM Cu(NO3)2
Vì thanh Fe còn dư ⇒ sản phẩm cuối cùng là Fe2+.
Ta có các pứ: 3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO + 4H2O.
Sau đó: Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓.
Ta có: mGiảm = mFe – mCu = 56×( 3 a + a 8 + a) – 64a = 1,04.
<=> 13a = 1,04 <=> a = 0,08 mol.
⇒ nHNO3 = 0,08 ∑ne trao đổi = 0,08 mol ⇒ t = 0 , 08 × 96500 2 = 3860 giây.

Đáp án A
Ta có: CM HNO3 = CM Cu(NO3)2
Vì thanh Fe còn dư
⇒ sản phẩm cuối cùng là Fe2+.
Ta có các pứ:
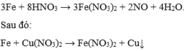
Ta có:
mGiảm = mFe – mCu
= 56×( + a) – 64a = 1,04.
Û 13a = 1,04
Û a = 0,08 mol.
⇒ nHNO3 = 0,08
∑ne trao đổi = 0,08 mol
⇒ t = 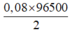 = 3860 giây
= 3860 giây

Gọi: nMg = 2x (mol) ⇒ nFe = x (mol)
⇒ 2x.24 + 56x = 5,2 ⇒ x = 0,05 (mol)
⇒ nMg = 0,1 (mol), nFe = 0,05 (mol)
BTNT Mg: nMg(NO3)2 = nMg = 0,1 (mol)
BTNT Fe: nFe(NO3)3 = nFe = 0,05 (mol)
Gọi: \(\left\{{}\begin{matrix}n_{N_2O}=a\left(mol\right)\\n_{NO}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow a+b=\dfrac{1,68}{22,4}=0,075\left(mol\right)\left(1\right)\)
Mà: Tỉ khối hhk so với kk là 1,195.
\(\Rightarrow44a+30b=1,195.29.0,075\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,025\left(mol\right)\\b=0,05\left(mol\right)\end{matrix}\right.\)
BTNT N, có: nHNO3 = 2nN2O + nNO + 2nMg(NO3)2 + 3nFe(NO3)3 = 0,45 (mol)
\(\Rightarrow x=C_{M_{HNO_3}}=\dfrac{0,45}{0,3}=1,5\left(M\right)\)