có thể điều chế oxi bằng cách đun nóng kali KClO3. Khi đun nóng 24.5g KClO3 chất rắn còn lại trong ống nghiệm là 13.45g. Tính khối lượng khí oxi thu được, biết hiệu suất phản ứng phân hủy là 80%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Theo định luật bảo toàn khối lượng, ta có khối lượng khí oxi thu được là:
m O 2 = 24,5 – 13,45 = 11,05(g)
Khối lượng thực tế oxi thu được: m O 2 = (11,05 x 80)/100 = 8,84 (g)

ĐLBTKL: \(m_{KClO_3}=m_{\text{chất rắn còn lại}}+m_{O_2}\)
\(\Rightarrow m_{O_2}=24,5-13,45=11,05\left(g\right)\)

Theo định luật bảo toàn khối lượng ta có: m O 2 = 15,8 – 12,6 = 3,2(g)
Hiệu suất của phản ứng phân hủy: H = 2,8/3,2 x 100 = 87,5%

\(a.2KClO_3-^{t^o}\rightarrow2KCl+3O_2\\ n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,6\left(mol\right)\\ \Rightarrow V_{O_2}=0,6.22,4=13,44\left(l\right)\\ n_{KCl}=n_{KClO_3}=0,4\left(mol\right)\\ \Rightarrow m_{KCl}=0,4.74,5=29,8\left(g\right)\)

\(n_{KClO_3\left(bd\right)}=\dfrac{55,125}{122,5}=0,45\left(mol\right)\)
=> \(n_{KClO_3\left(pư\right)}=\dfrac{0,45.85}{100}=0,3825\left(mol\right)\)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
0,3825------------------->0,57375
=> \(V_{O_2}=0,57375.22,4=12,852\left(l\right)\)

a.\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
2 2 3 ( mol )
0,1 0,15
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)
b.\(V_{kk}=V_{O_2}.5=3,36.5=16,8l\)
c.\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{28}{56}=0,5mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
3 2 1 ( mol )
0,5 > 0,15 ( mol )
0,225 0,15 ( mol )
\(m_{Fe\left(du\right)}=n_{Fe\left(du\right)}.M_{Fe}=\left(0,5-0,225\right).56=15,4g\)

Câu 3.
a.b.\(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2mol\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,2 0,3 ( mol )
\(V_{O_2}=0,3.22,4=6,72l\)
c.\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,2 < 0,3 ( mol )
0,2 0,1 ( mol )
\(m_{Al_2O_3}=0,1.102=10,2g\)
Câu 4.
a.b.
\(n_{KClO_3}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,1 0,15 ( mol )
\(V_{O_2}=0,15.22,4=3,36l\)
c.\(n_{Fe}=\dfrac{8,4}{56}=0,15mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,15 < 0,15 ( mol )
0,15 0,05 ( mol )
\(m_{Fe_3O_4}=0,05.232=11,6g\)

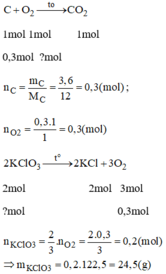
\(m_{KClO_3}pu=\dfrac{24,5.80\%}{100\%}=19,6g\)
theo BTKL
\(m_{O_2}=m_{KClO_3pu}-m_{KCl}=19,6-13,45=6,15\left(g\right)\)