Dung dịch X chứa 0.01 mol Fe3+, 0.02 mol NH4+, 0.02 mol SO4 2-
và x mol
3NO−.
a. Tính x.
b. Trộn dung dịnh X với 100 ml dung dịch Ba(OH)2 0.3 M thu được m gam kết tủa và V lít khí (đktc). Tính m và V.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A
nOH- = 0,06x2 = 0,12 > nNH3 = 0,08 Þ OH- dư Þ Trong X có chứa nNH4+ = 0,08
BTĐT => n S O 4 2 - = (0,12 + 0,08 - 0,l)/2 = 0,05 < nBa2+ = 0,06 Þ Có 0,05 mol BaSO4 kết tủa
Þ Trong Z có nBa2+ = 0,06 - 0,05 = 0,01; nK+ = 0,12; nCl- = 0,1; nOH- = 0,12 - 0,08 = 0,04
Vậy m = 0,01x137 + 0,12x39 + 0,1x35,5 + 0,04x17 = 10,28.

Ta có: $n_{NaHCO_3/sauphanung}=3,5x-0,8(moL)$
$n_{NaCl}=n_{HCl}=0,8(mol)$
$\Rightarrow 84.(3,5x-0,8)+0,8.58,5=103,08$
$\Rightarrow x=0,42\Rightarrow m=206,85(g)$

Chọn đáp án A
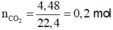
100 ml X + Ba(OH)2 dư → 0,2 mol BaCO3 ↓
![]()
100 ml X + HCl:
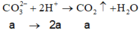
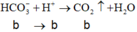
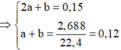
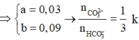
Trong 200 ml
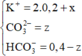
![]()
⇒ n C O 3 2 - = 0 , 1 m o l ; n H C O 3 - = 0 , 3 m o l
→ B T N T x = 0 , 1 . 2 + 0 , 3 - 0 , 2 . 2 = 0 , 1
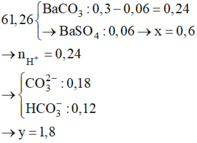


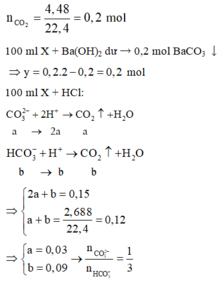
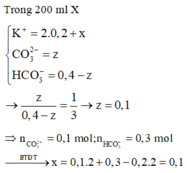
a.
Bảo toàn điện tích :
\(n_{NO_3^-}=0.01\cdot3+0.02-0.02\cdot2=0.01\left(mol\right)\)
b.
\(n_{Ba\left(OH\right)_2}=0.1\cdot0.3=0.03\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.02.....0.02..........0.02\)
\(Ba^{2+}dư\)
\(m_{BaSO_4}=0.02\cdot233=4.66\left(g\right)\)
\(NH_4^++OH^-\rightarrow NH_3+H_2O\)
\(0.02.......0.02........0.02\)
\(V_{NH_3}=0.02\cdot22.4=0.448\left(l\right)\)
\(OH^-dư\)