Khử hoàn toàn 4,06 gam một oxit kim loại bằng khí CO ở nhiệt độ cao thu được kim loại dẩn toàn bộ khí sinh ra vào bình đựng dung dịch Ca(OH)2 dư tạo nên 7 gam kết tủa . Nếu lấy lượng kim loại mới sinh ra hòa tan hết vào dung dịch HCl dư thì thấy có 1,176 lít khí (đktc) thoát ra . Xác định oxit kim loại.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi công thức oxit ban đầu là MxOy.
Có phản ứng khử hoàn toàn oxit MxOy thành kim loại:
![]()
Dẫn khí CO2 sinh ra hấp thụ vào dung dịch Ca(OH)2 dư:
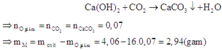
Cần lưu ý: Hóa trị của kim loại M trong oxit ban đầu và hóa trị của M trong sản phẩm của phản ứng giữa M với axit HCl có thể khác nhau.
Do đó ta gọi n là hóa trị của M thể hiện khi phản ứng với axit HCl.
![]()
Áp dụng định luật bào toàn mol electron, ta có:
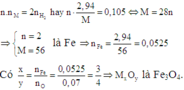
Đáp án D.

Gọi CT của oxit cần tìm là RxOy
RxOy+yCO→xR+yCO2 (1)
CO2+Ca(OH)2→CaCO3+H2O (2)
Vì Ca(OH)2 dư nên nCO2=n↓=0,07 mol
Theo PTHH (1), nO trong oxit=nCO2=0,07 mol
→mO trong oxit=0,07.16=1,12 g
→mR trong oxit=4,06−1,12=2,94 g
+) Cho kim loại R tác dụng với dung dịch HCl
PTHH: 2R+2nHCl→2RCln+nH2 (3)
Ta có: nH2=0,0525 mol
Theo (3), nR=\(\dfrac{2}{n}\)H2=\(\dfrac{0,105}{n}\)
→\(\dfrac{0,105}{n}R\)=2,94→R=28n
Chỉ có cặp nghiệm duy nhất thỏa mãn:
\(\left\{{}\begin{matrix}n=2\\R=56\left(Fe\right)\end{matrix}\right.\)
→nFe=0,0525 mol
Khi đó ta có: \(\dfrac{x}{y}:\dfrac{nFe}{nO}:\dfrac{0,0525}{0,07}=\dfrac{3}{4}\)
Vậy CT của oxit kim loại cần tìm là: Fe3O4

Đáp án C
nCO2 = nCaCO3 = 0,07 mol
O + CO → CO2
0,07 ← 0,07
mKL = moxit – mO
= 4,06 – 0,07.16 = 2,94 (g)
Gọi hóa trị của KL khi tác dụng với HCl là n
M → 0,5n H2
0,105/n← 0,0525 (mol)
![]()
![]()
![]()
![]()

\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
Gọi CTHH của oxit là XaOb
PTHH: XaOb + bCO --to--> aX + bCO2
\(\dfrac{0,2}{b}\)<---------------\(\dfrac{0,2a}{b}\)<-0,2
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,2<------0,2
=> \(M_{X_aO_b}=a.M_X+16b=\dfrac{16,2}{\dfrac{0,2}{b}}=81b\left(g/mol\right)\)
=> \(\dfrac{a}{b}=\dfrac{65}{M_X}\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2X + 2nHCl --> 2XCln + nH2
\(\dfrac{0,4}{n}\)<---------------------0,2
=> \(\dfrac{0,2a}{b}=\dfrac{0,4}{n}\)
=> \(\dfrac{13}{M_X}=\dfrac{0,4}{n}\) => \(M_X=\dfrac{65}{2}n\left(g/mol\right)\)
- Nếu n = 1 => Loại
- Nếu n = 2 => MX = 65 (g/mol)
=> X là Zn
\(\dfrac{x}{y}=1\) => CTHH: ZnO
- Nếu X = 3 => Loại
Vậy CTHH của oxit là ZnO
Gọi oxit kim loại là MxOy.
MxOy + yCO → xM + yCO2
nCaCO3 = 0,2 mol → nCO2 = 0,2 mol
Số mol của oxi có trong oxit = số mol CO = số mol CO2 = 0,2 mol
→ khối lượng của oxi có trong oxit là 0,2.16 = 3,2 gam
mO + mM = 16,2 gam → mM = 13 gam
2M + 2nHCl → 2MCln + nH2
0,2.2/n ← 0,2 mol
mM = 13 gam, nM = 0,4/n mol
→ M = 13.n/0,4 = 32,5n
Xét n = 1 → M = 32,5 (loại)
n = 2 → M = 65 → M là Zn
nZn : nO = 1 : 1 → Công thức của oxit là ZnO

BL
CO2+Ca(OH)2==>CaCO3+H20
0.07<= 0.07
đây là bài toán lừa đó bạn ạ . hóa trị của KL thay đổi nên gọi n m lan luot la hoa trị trong oxit và trong KL
ta gọi KL la M
M+ nHCL= MCLm+ (n/2) H2
1.76/22.4
từ PT khử thành KL áp dụng định luật BTKL ta có
mM=4.06+0.07*28-0.07*44=2.94 g
==> M=18.7n
xét từng trường hợp => M=56==> Fe . CT oxit Fe3O4
Chúc bn học tốt![]()

M2On+nCO->nCO2+2M
2M+2nHCl->2MCln+nH2
nCO2=14/100=0,14(mol)
=>mM=8,12-0,14x16=5,88(g)
nH2=2,352/22,4=0,105(mol)
=>nM=0,21/n(mol)
M=5,88:0,21/n=28n
n=2 M=56=>M là Fe
Ta có nFe:nO=0,105:0,14=3: 4
=>CTHH oxit là Fe3O4
Khí sinh ra là CO2.
Có: \(n_{CaCO_3}=\dfrac{14}{100}=0,14\left(mol\right)\)
PT: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
___0,14_______________0,14 (mol)
Bản chất của khử oxit kim loại: \(CO+O_{\left(trongoxit\right)}\rightarrow CO_2\)
⇒ nO (trong oxit) = 0,14 (mol)
Mà: m oxit = mKL + mO (trong oxit)
⇒ mKL = 8,12 - 0,14.16 = 5,88 (g)
Giả sử KL đó là A, có hóa trị n.
Ta có: \(n_{H_2}=\dfrac{2,352}{22,4}=0,105\left(mol\right)\)
PT: \(2A+2nHCl\rightarrow2ACl_n+nH_2\)
Theo PT: \(n_A=\dfrac{2}{n}n_{H_2}=\dfrac{0,21}{n}\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{5,88}{\dfrac{0,21}{n}}=28n\left(g/mol\right)\)
Với n = 2, MA = 56 (g/mol) là thỏa mãn.
⇒ A là Fe và \(n_{Fe}=\dfrac{5,88}{56}=0,105\left(mol\right)\)
Giả sử oxit cần tìm có công thức là FexOy.
\(\Rightarrow x:y=0,105:0,14=3:4\)
Vậy: Oxit cần tìm là Fe3O4 (Oxit sắt từ)
Bạn tham khảo nhé!
( Hóa trị của kim loại trong oxit và trong muối chưa chắc bằng nhau)
Đặt CTTQ của oxit kim loại là: RxOy
RxOy + yCO → xR + yCO2 (1)
CO2 + Ca(OH)2 → CaCO3 ¯ + H2O (2)
Theo (1) và (2): nO ( oxit) = \(n_CO_2\)= 7/100 = 0,07 mol
mR = 4,06 – 0,07. 16 = 2,94 gam
Gọi n là hóa trị kim loại trong muối clorua
2R + 2nHCl →2RCln + nH2 (3)
\(\dfrac{0,105}{n}\) ← 0,0525 (mol)
MR = \(\frac{2,94}{0,105/n}\) = 28n (1\(\le\) n \(\le\) 3) Biện luận được n = 2, MR = 28 ( Fe)
Theo ĐL thành phần không đổi ta có: \(\dfrac{56x}{16y}=\dfrac{2,94}{0,07.16}\Rightarrow\dfrac{x}{y}=\dfrac{3}{4}\)
CTHH của oxit kim loại là: Fe3O4
Chúc bạn học tốt!
Gọi công thức oxit kim loại:MxOy
_Khi cho tác dụng với khí CO tạo thành khí CO2.
MxOy+yCO=>xM+yCO2
_Cho CO2 tác dụng với dd Ca(OH)2 tạo thành CaCO3:
nCaCO3=7/100=0.07(mol)=nCO2
CO2+Ca(OH)2=>CaCO3+H2O
0.07------------------>0.07(mol)
=>nO=0.07(mol)
=>mO=0.07*16=1.12(g)
=>mM=4.06-1.12=2.94(g)
_Lượng kim loại sinh ra tác dụng với dd HCl,(n là hóa trị của M)
nH2=1.176/22.4=0.0525(mol)
2M+2nHCl=>2MCln+nH2
=>nM=0.0525*2/n=0.105/n
=>M=28n
_Xét hóa trị n của M từ 1->3:
+n=1=>M=28(loại)
+n=2=>M=56(nhận)
+n=3=>M=84(loại)
Vậy M là sắt(Fe)
=>nFe=0.105/2=0.0525(mol)
=>nFe:nO=0.0525:0.07=3:4
Vậy công thức oxit kim loại là Fe3O4.