Nung nóng hỗn hợp A gồm Al và Fe304( khôg có không khí)
Hỗn hợp thu dc sau pư tác dụng dd KOH dc 6,72l đktc
Nếu sản phẩm tác dụng với HCl dư dc 26,88l h2 đktc. Tìm khối lượng mỗi chất trong A
Help me, please
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Số mol S O 2 = 1,5x + 0,03 = 0,06375→ x = 0,0225 mol
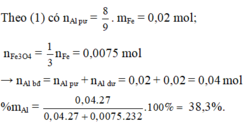
⇒ Chọn C.

Gọi số mol Na, Zn là a, b
=> 23a + 65b = 14,3
n H2=\(\dfrac{2,24}{22,4}\)=0,1 mol
- Nếu Zn tan hết
2Na + 2H2O --> 2NaOH + H2
a-------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
2b<----b-------------------->b
->\(\left\{{}\begin{matrix}2b\text{≤}a\\0,5a+b=14,3\end{matrix}\right.\) loại
=> Zn không tan hết => NaOH hết
PT:2Na + 2H2O --> 2NaOH + H2
a------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
\ a--------------------------->0,5a
=> 0,5a + 0,5a = 0,1
=> a = 0,1
=> mNa = 0,1.23 = 2,3 (g)
=> mZn = 14,3 - 2,3 = 12(g)
PTP. ứng:
Fe+S----> FeS
Fe+ 2HCl--> FeCl2+H2
x x (mol)
FeS+ 2HCl--> FeCl2+ H2S
y y (mol)
Gọi n H2 và H2S trong C lần lượt là x và y mol, ta có hpt:
x+y=0.1
(2x+32y)/2(x+y)=13
--> x=0.02, y=0.08
--> tổng m Fe+n FeS= n Fe tỏng A=x+y=0.1 mol
m Fe=0.1.56=5.6 (g)

Đáp án C
8 Al + 3 Fe 3 O 4 → t o 4 Al 2 O 3 + 9 Fe
Vì phản ứng xảy ra hoàn toàn và hòa tan A vào dung dịch NaOH thu được khí nên A gồm Fe, A12O3 và Al dư.


a) \(2Al+6HCl\rightarrow2AlCl_3+3H_2\left(1\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\left(2\right)\\ 2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\)
Cho hỗn hợp tác dụng với NaOH, chất rắn không tan là Fe
=> mFe= 1,12 (g) \(\Rightarrow n_{Fe}=0,02\left(mol\right)\)
Ta có: \(n_{H_2\left(2\right)}=n_{Fe}=0,02\left(mol\right)\)
=> \(n_{H_2\left(1\right)}=\Sigma n_{H_2}-n_{H_2\left(2\right)}=0,065-0,02=0,045\left(mol\right)\)
\(\Rightarrow n_{Al}=\dfrac{2}{3}n_{H_2\left(1\right)}=0,03\left(mol\right)\)
\(\Rightarrow m_{Al}=0,03.27=0,81\left(g\right)\)
\(\Rightarrow\%m_{Al}=41,97\%,\%m_{Fe}=58,03\%\)
b) \(m_{FeCl_2}=0,02.127=2,54\left(g\right)\\ m_{AlCl_3}=0,03.133,5=4,005\left(g\right)\)

- Xét TN2:
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,2<--------------------------------0,3
=> mAl = 0,2.27 = 5,4 (g)
- Xét TN1:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2------------------->0,3
Mg + 2HCl --> MgCl2 + H2
0,15<------------------0,15
=> mMg = 0,15.24 = 3,6 (g)



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(0.2.................0.1...........0.1...........0.1\)
Bảo toàn khối lượng :
\(m_{O_2}=37.92-34.72=3.2\left(g\right)\)
\(n_{O_2}=\dfrac{3.2}{32}=0.1\left(mol\right)\)
\(m_{KMnO_4\left(dư\right)}=37.92-0.2\cdot158=6.32\left(g\right)\)
\(m_{K_2MnO_4}=0.1\cdot197=19.7\left(g\right)\)
\(m_{MnO_2}=0.1\cdot87=8.7\left(g\right)\)
\(b.\)
Để hỗn hợp nổ mạnh nhất thì H2 phản ứng với O2 theo tỉ lệ 2 : 1
\(2H_2+O_2\underrightarrow{^{^{t^0}}}2H_2O\)
\(0.2......0.1\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\dfrac{2}{15}...........................0.2\)
\(m_{Al}=\dfrac{2}{15}\cdot27=3.6\left(g\right)\)

Coi hỗn hợp X gồm R ( có hoá trị n - a mol) và Fe (b mol)
$\Rightarrow Ra + 56b = 6$
$2R + 2nHCl \to 2RCl_n + nH_2$
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH : $n_{H_2} = 0,5an + b = \dfrac{1,85925}{22,4} = 0,083(mol)(1)$
$2R + nCl_2 \xrightarrow{t^o} 2RCl_n$
$2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3$
$m_{Cl_2} = m_{muối} - m_X = 12,39 - 6 = 6,39(gam)$
$n_{Cl_2} = 0,5an + 1,5b = 0,09(2)$
Từ (1)(2) suy ra : an = 0,138 ; b = 0,014
$\%m_{Fe} = a\% = \dfrac{0,014.56}{6}.100\% = 13,07\%$
Pư tạo khí với KOH dư: Al + KOH + H2O ---> KAlO2 + 3/2 H2
=> nAl dư = (6,72/22,4).2/3 = 0,2 mol.
Pư tạo khí với HCl:
Al dư + 3HCl ---> AlCl3 + 3/2 H2
Fe + 2HCl ---> FeCl2 + H2
ta có nFe = (26,88/22,4) - 0,2.3/2 = 0,9 mol.
Pư: 8Al + 3Fe3O4 ---> 4Al2O3 + 9Fe
0,8 <------0,3<--------------0,9 mol
Vậy Hỗn hợp đầu có 0,8 + 0,2 = 1 mol Al và 0,3 mol Fe3O4