Khi đốt nóng, 1g magie (Mg) kết hợp được với 2,96g clo (Cl) tạo ra hợp chất magie clorua. Tìm công thức hóa học của magie clorua, biết phân tử của chấp chất chỉ có một nguyên tử magie.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Phản ứng xảy ra như sau:
2Mg + xCl2 \(\rightarrow\) 2MgClx
1/24 2,96/71
Ta có: x/24 = 2.2,96/71
x = 2.

Khi đun nóng :
1g Mg ................................................2,96g Cl
Vậy
24g Mg ....................................................71g Cl
nMg=24/24=1(mol)
nCl=71/35,5=2(mol)
Vậy công thức hoá học của hợp chất là

nMg=m/M= 1/24 (mol)
nCl2= m/M=2.96/71 (mol)
Gọi: CT của muối : MgClx
2Mg + xCl2 -to-> 2MgClx
2_______x
1/24_____2.96/71
<=> 1/24*x = 2.96/71*2
=> x = 2
Vậy: CT của muối : MgCl2

bài 1: gọi công thức là CxHy
ta có: %C=81,82%=>%H=100-81,82=18,18%
theo đề ta có x:y=\(\frac{81,82}{12}:\frac{18,18}{1}\)=2:5
vậy công thức là C2H5

Giả sử hợp chất có khối lượng 7g → m M g = 3g ; m S = 4g
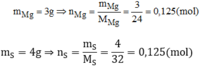
Vậy trong hợp chất: 0,125 mol nguyên tử Mg và 0,125 mol nguyên tử S. Có nghĩa là 1 mol nguyên tử Mg kết hợp với 1 mol nguyên tử S.
Nên công thức hóa học đơn giản của magie sunfua: MgS.

a) Mg + Cl2 --to--> MgCl2
Tỉ lệ Mg : Cl2 = 1:1
b) Theo ĐLBTKL:
\(m_{Mg}+m_{Cl_2}=m_{MgCl_2}\)
=> \(m_{Cl_2}=19-4,8=14,2\left(g\right)\)
=> \(n_{Cl_2}=\dfrac{14,2}{71}=0,2\left(mol\right)\)
=> \(V_{Cl_2}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{MgCl_2}=\dfrac{3.10^{23}}{6.10^{23}}=0,5\left(mol\right)\)
PTHH: Mg + Cl2 --to--> MgCl2
______0,5<--0,5<--------0,5__________(mol)
=> Số nguyên tử Mg = 0,5.6.1023 = 3.1023
=> Số phân tử Cl2 = 0,5.6.1023 = 3.1023

a) CTTQ MgxSy (x,y: nguyên, dương)
Ta có: mMg/ mS= 3/4
<=> 24x/32y=3/4
<=>x/y=1/1
=> CTHH đơn giản: MgS
b) nMg= 1/3 (mol)
nS= 0,25(mol)
PTHH: Mg + S -to-> MgS
Ta có: 1/3 : 1 > 0,25/1
=> Mg dư, S hết, tính theo nS
=> nMgS=0,25(mol) -> mMgS= 56.0,25=14(g)
mMg(dư)= 8 - 0,25.24=2(g)
=> Chọn D

a) Phương trình hóa học của phản ứng:
Mg + H2SO4 → MgSO4 + H2
b) Số nguyên tử Mg : số phân tử H2SO4 = 1:1
Số nguyên tử Mg : số phân tử MgSO4 = 1:1
Số nguyên tử Mg : số phân tử H2 = 1:1.
Khi đun nóng :
1g Mg ................................................2,96g Cl
Vậy
24g Mg ....................................................71g Cl
\(n_{Mg}=\dfrac{24}{24}=1\left(mol\right)\)
\(n_{Cl}=\dfrac{71}{35,5}=2\left(mol\right)\)
Vậy công thức hoá học của hợp chất là \(MgCl_2\)