bài1: cho khí co đi qua ống chứa 48 gam fe2o3 nung nóng. sau phản ứng thu được hỗn hợp X gồm Fe, Fe2O3,Fe3O4,FeO. hòa tan hỗn hợp X bằng dung dịch HNO3. Sau phản ứng thu được dung dịch Y.Cô cạn dung dịch Y thu được m gam muối. tính m
bài2: Để 56 gam Fe trong không khí sau 1 thời gian thu được hỗn hợp A gồm Fe, FeO, Fe2O3,Fe3O4 có khối luuwongj 60.8 gam. Hòa tan hỗn hợp A bằng dung dịch HCl 1M thu được dung dịch B. Cho dung dịch B tác dụng với NaOH dư thu được kết tủa C. lọc kết tủa C, nung trong không khí với khối lượng không đổi thu được m gam chất rắn. a)tính ***** HCl đã dùng. b)tính m

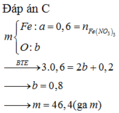


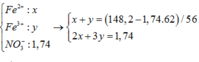


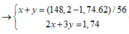
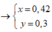
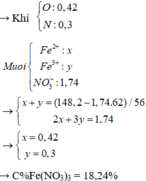

bài 1: cho khí CO đi qua ống chứa 48 gam fe2o3 nung nóng. sau phản ứng thu được hỗn hợp X gồm Fe, Fe2O3,Fe3O4,FeO. hòa tan hỗn hợp X bằng dung dịch HNO3. Sau phản ứng thu được dung dịch Y.Cô cạn dung dịch Y thu được m gam muối. tính m.
Số mol Fe2O3 phản ứng:
\(n_{Fe_2O_3}=\dfrac{48}{160}=0,3\left(mol\right)\)
Số mol Fe là:
\(n_{Fe}=0,3.2=0,6\left(mol\right)\)
PTHH:
\(CO+Fe_2O_3\rightarrow CO_2\uparrow+Fe\\ CO+Fe_2O_3\rightarrow CO_2\uparrow+Fe_3O_4\\ CO+Fe_2O_3\rightarrow CO_2+FeO\\ Fe_2O_3\left(dư\right)\)
Theo định luật bảo toàn khối lượng \(\Rightarrow\) trong hỗn hợp X cũng có 0,6mol Fe.
Do HNO3 là một axit có tính oxi hóa rất mạnh nên sau khi tác dụng với hỗn hợp X phần dung dịch Y sinh ra sẽ chỉ có một muối duy nhất là Fe(NO3)3
Do số mol Fe vẫn được bảo toàn nên
\(n_{Fe\left(NO_3\right)_3}=n_{Fe}=0,6\left(mol\right)\)
Khối lượng muối sau khi cô cạn là:
\(m_{Fe\left(NO_3\right)_3}=m=0,6.242=145,2\left(g\right)\)
Số mol Fe phản ứng là:
\(n_{Fe}=\dfrac{56}{56}=1\left(mol\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\\ FeO+2HCl\rightarrow FeCl_2+H_2O\\ Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\\ Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
Từ các phương trình ta thấy dung dịch B chỉ có FeCl2 và FeCl3.
Cho dung dịch B tác dụng với NaOH dư.
PTHH:
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\\ FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3+3NaCl\)
Kết tủa C gồm có Fe(OH)2 và Fe(OH)3.
Lọc và nung kết tủa C trong không khí.
PTHH:
\(4Fe\left(OH\right)_2+O_2\xrightarrow[......]{t^o}2Fe_2O_3+4H_2O\\ 2Fe\left(OH\right)_3\xrightarrow[......]{t^o}Fe_2O_3+3H_2O\)
Theo định luật bảo toàn khối lượng thì khối lượng Fe vẫn không thay đổi do đó số mol Fe vẫn là 1mol, số mol Fe2O3 sau phản ứng là.
\(n_{Fe}=1\left(mol\right)\Rightarrow n_{Fe_2O_3}=\dfrac{1}{2}=0,5\left(mol\right)\)
Khối lượng Fe2O3 (chất rắn) thu được sau phản ứng là:
\(m_{Fe_2O_3}=m=0,5.160=80\left(g\right)\)
Còn phần a thì mình không biết đề bài hỏi gì.