Khi hòa tan 30,0 g hỗn hợp đồng và đồng (II) oxit trong 1,50 lít dung dịch axit nitric 1,00 M (loãng) thấy thoát ra 6,72 lít nitơ monoaxit (đktc). Xác định hàm lượng phần trăm của đồng (II) oxit trong hỗn hợp, nồng độ mol của đồng (II) nitrat và axit nitric trong dung dịch sau phản ứng, biết rằng thể tích dung dịch không thay đổi.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHNO3 = 1,5. 1,00 = 1,50 (mol)
nNO = 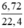 = 0,3(mol)
= 0,3(mol)
PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1)
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
Theo pt(1) nCu = 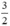 . nNO =
. nNO = 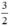 . 0,3 = 0,45 mol
. 0,3 = 0,45 mol
Gọi nCuO = x mol
Ta có: mhỗn hợp = mCu + mCuO = 0,45. 64 + 80x = 30,00
⇒ x = 0,015 ⇒ nCuO = 0,015 mol ⇒ mCuO = 0,015. 80 = 1,2 g
(Hoặc mCuO = 30 - 0,45. 64 = 1,2g)
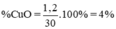
Theo pt(1) nCu(NO3)2 = nCu = 0,45 mol
Theo pt(2) nCu(NO3)2 = nCuO = 0,015 mol
⇒ Tổng nCu(NO3)2 = 0,45 + 0,015 = 0,465(mol)
CMCu(NO3)2 = 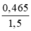 = 0,31(M)
= 0,31(M)
Theo pt (1) nHNO3 = 4. nNO = 4. 0,3 = 1,2 mol
Theo pt (2) nHNO3 = 2. nCuO= 2. 0,015 = 0,03 mol
nHNO3 (dư)= 1,5 - 1,2 – 0,03 = 0,27(mol)
CM HNO3 = 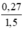 = 0,18(M)
= 0,18(M)

n HNO3 = 1,5 . 1 = 1,5 mol
n NO = 6,72 / 22,4 = 0,3 (mol)
0 +2
Cu -> Cu + 2e
0,45 <--------- 0.9
+5 +2
N + 3e -> NO
0.9 <- 0.3
m Cu = 0.45 . 64 =28.8 (g)
m CuO = 30 - 28,8 = 1,2 (g)
% m CuO = 1,2 / 30 x 100% = 4%
4H(+) + NO3(-) --> NO + 2H2O
1,2 <------ 0,3 <------ 0.3
n CuO = 1,2 / 80 = 0,015 (mol)
2HNO3 + CuO --> Cu(NO3)2 + H2O
0.03 <----- 0,015
=> n HNO3 còn = 1,5 - 1,2 - 0,03 = 0,27 (mol)
CM HNO3 = 0,27 / 1,5 = 1,8 M
CM Cu(NO3)2 = 0,465 / 1,5 = 0,31 M

Đáp án: A.
Hướng dẫn:
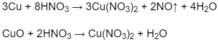
Số mol khí NO:
![]()
Theo phản ứng (1) số mol Cu:
![]()
Khối lượng Cu trong hỗn hợp ban đầu : m C u = 0,45.64 = 28,8 (g).
Khối lượng CuO trong hỗn hợp ban đầu : m C u O = 30 - 28,8 = 1,2 (g).

\(\left\{{}\begin{matrix}n_{Cu}\\n_{Fe}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}64x+56y=24,4\\2x+3y=\dfrac{6,72}{22,4}.3\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,285\\y=0,11\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Cu}=74,75\%\\\%m_{Fe}=25,25\%\end{matrix}\right.\)

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.


Phương trình hóa học của phản ứng:
C O 2 + Ca OH 2 → Ca CO 3 + H 2 O
CuO + CO → t ° C O 2 + Cu
Theo phương trình ta có:
n CO 2 = n CaCO 3 = 5/100 = 0,05 mol
n CO = n Cu = 3,2/64 = 0,05 mol
n CaCO 3 = 5/100 = 0,05 mol
n Cu = 3,2/64 = 0,05 mol
Như vậy: n hh = 10/22,4 = 0,45 mol; n N 2 = 0,45 - 0,05 - 0,05 = 0,35 mol
% V N 2 = 0,35/0,45 x 100% = 77,78%
% V CO 2 = % V CO = 0,05/0,45 x 100% = 11,11%
Nếu cho phản ứng (2) thực hiện trước rồi mới đến phản ứng (1) thì
∑ n CO 2 = 0,05 + 0,05 = 0,1 mol
n CaCO 3 = 0,1 mol
Vậy m CaCO 3 = 0,1 x 100 = 10g

Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(Fe+4HNO_{3l}\rightarrow Fe\left(NO_3\right)_3+NO+2H_2O\)
\(3Cu+8HNO_{3l}\rightarrow3Cu\left(NO_3\right)_2+2NO+4H_2O\)
\(n_{NO}=\dfrac{6,72}{22,4}=0,3mol\)
\(\Rightarrow\left\{{}\begin{matrix}56a+64b=24,8\\BTe:3a+2b=3\cdot0,3\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,3\end{matrix}\right.\)
\(\%m_{Fe}=\dfrac{0,1\cdot56}{24,8}\cdot100\%=22,58\%\)
\(\%m_{Cu}=100\%-22,58\%=77,42\%\)
nNO = \(\dfrac{6,72}{22,4}\) = 0,300 (mol)
nHNO3nHNO3 = 1,00 x 1,5 = 1,5 (mol)
pthh: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1)
Theo (1) ta tính được nCu = 0,45 mol => mCu = 28,8 gam
nHNO3nHNO3 = 1,2 mol
nCu(NO3)2nCu(NO3)2 = 0,45 mol
mCuO = 30 gam – 28,8 gam = 1,2 gam => nCuO = 0,015 mol
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
Theo (2) ta tính được nHNO3nHNO3 là 0,030 mol, nCu(NO3)2nCu(NO3)2 là 0,015 mol
Phần tram khối lượng CuO: % mCuO = \(\dfrac{1,2}{30}\) . 100% = 4,0 %
Từ (1) và (2) ta tính được số mol HNO3 dư là 0,27 mol.
Nồng độ mol HNO3 sau phản ứng: 0,18 M
Nồng độ mol của Cu(NO3)2: 0,31 M