Đốt chấy hỗn hợp S và Zn trong bình kín theo tỉ lệ 1:2 về khối lượng. Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn X. Xác định thành phần chất rắn X.
Mọi người giải giùm em nhanh nha! Gấp lắm rồi!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cái này sai đề rồi em, anh lập hệ pt mà bấm ra số mol âm
đúng anh à
em ra đc \(n_{Mg}=1,85\left(mol\right);n_{Al}=-\dfrac{16}{15}\left(mol\right)\)

Gọi số mol FeCO3, ZnCO3 là a, b (mol)
PTHH: FeCO3 --to--> FeO + CO2
a----------->a
ZnCO3 --to--> ZnO + CO2
b--------->b
mbđ = 116a + 125b (g)
msau pư = 72a + 81b (g)
=> \(\dfrac{72a+81b}{116a+125b}=\dfrac{6,21}{9,73}\)
=> 19,8a = 11,88b
=> a = 0,6b
\(\%m_{FeCO_3}=\dfrac{116a}{116a+125b}.100\%=\dfrac{116.0,6b}{116.0,6b+125b}.100\%=35,766\%\)
=> \(\%m_{ZnCO_3}=100\%-35,766\%=64,234\%\)
Với các bài tập chỉ có tỉ lệ và phần trăm, có thể đặt một lượng chất bất kì. Đối với bài này, đặt khối lượng chất rắn thu được là 6,21 gam, khối lượng muối ban đầu là 9,73 gam
FeCO3 → FeO + CO2 ZnCO3 → ZnO + CO2
a a b b mol
mFeCO3 + mZnCO3 = 116a + 125b = 9,73 gam
mFeO + mZnO = 72 + 81b = 6,21 gam
a = 0,03 mol; b = 0,05 mol

Đáp án : B
Xét 1 mol không khí : 0,2 mol O2 và 0,8 mol N2
%nN2 = 84,77% => nY = 0,94373 mol
=> nSO2 = 0,1 mol
,nO2 dư = 0,0437 mol
=> nO2 pứ = 0,2 – 0,044 = 0,1563 mol
2FeS + 3,5O2 -> Fe2O3 + 2SO2
.a -> 1,75a
2FeS2 + 5,5O2 -> Fe2O3 + 4SO2
.b -> 2,75b
=> ¼ (7a + 11b) = 0,1563
.a + 2b = 0,1
=> a = 0,05 mol ; b = 0,025 mol
=> mX = 7,4g
=> %mFeS = 59,46%

mgiảm = mO2 (sinh ra) = 200 + 3 - 145,4 = 57,6 (g)
\(\rightarrow n_{O_2}=\dfrac{57,6}{32}=1,8\left(mol\right)\)
PTHH: 2KClO3 --to, MnO2--> 2KCl + 3O2
1,2 1,8
\(\rightarrow m_{KClO_3}=1,2.122,5=147\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}\%m_{KClO_3}=\dfrac{147}{200}=73,5\%\\\%m_{KCl}=100\%-73,5\%=26,5\%\end{matrix}\right.\)
Khối lượng oxi thoát ra: 197 + 3 – 152 = 48(g)
Số mol O2=4832=1,5(mol)O2=4832=1,5(mol)
Phương trình hóa học của phản ứng :
2KClO3MnO2,to⟶2KCl+3O22KClO3⟶MnO2,to2KCl+3O2
2 mol 3 mol
1,5×23=1mol1,5×23=1mol ←← 1,5 mol
Khối lượng KClO3KClO3 trong hỗn hợp : 1 x 122,5 =122,5 (g)Khối lượng KCl trong hỗn hợp ban đầu: 197 – 122,5 = 74,5(g)→%mKClO3=62,18%;%mKCl=37,82%→%mKClO3=62,18%;%mKCl=37,82%

Đáp án A
Chọn 100 mol không khí.
Tỉ lệ thể tích cũng là tỉ lệ số mol nên
![]()
Gọi 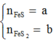
Có
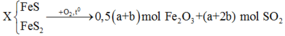

![]()
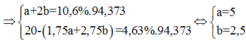
Đặt \(mS=a(g)\)
\(=>mZn=2a(g)\)
\(PTHH:\)\(Zn+S-t^o->ZnS\)
\(nS=\dfrac{a}{32}(mol)\)
\(nZn=\dfrac{2a}{65}=\dfrac{a}{32,5}(mol)\)
So sanh: \(nS>nZn\)
=> S dư sau phản ứng.
Hỗn hợp chất rắn X sau phản ứng gồm: \(\left\{{}\begin{matrix}ZnS\\S\left(dư\right)\end{matrix}\right.\)