Trong công nghiệp, người ta sử dụng cacbon để làm nhiên liệu. Tính nhiệt lượng toả ra khi đốt cháy 5 kg than chứa 90% cacbon, biết 1 mol cacbon cháy toả ra 394 kJ.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_C=\dfrac{5000.90}{100}=4500\left(g\right)\)
=> \(n_C=\dfrac{4500}{12}=375\left(mol\right)\)
=> Nhiệt lượng tỏa ra = 375.394 = 147750 (kJ)

![]()
Trong 5 kg than có chứa 0,9.5 = 4,5 kg cacbon = 4500 gam
Số mol C = 4500 / 12 = 375 mol
=> nhiệt lượng tỏa ra = 375.394 = 147750 kJ
Đáp án: B

Nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 kg etilen là :
1423/28 x 1000g = 50821,4kJ
Nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 kg axetilen là :
1320/26 x 10006 = 50769,2kJ

Số mol của axetilen là :
11,2/22,4 x 20/100 = 0,1 mol
Số mol của etilen là :
11,2/22,4 x 80/100 = 0,4 mol
Vậy nhiệt lượng toả ra khi đốt là
(0,1 x 1320) + (0,4 x 1423) = 701,2 (kJ).

1. Trong 1000 m 3 khí thiên nhiên có 850 m 3 C H 4
2 C H 4 → 1500 ° C C 2 H 2 + 3 H 2
CH ≡ CH + HCl → 150 - 200 ° C , H g C l 2 C H 2 = C H - C l
Khối lượng vinyl clorua thu được (nếu hiệu suất các quá trình là 100%) là:
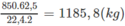
Với hiệu suất cho ở đầu bài, khối lượng vinyl clorua là:
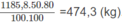
2. Nhiệt lượng cần dùng để làm nóng 100 lít nước từ 20 ° C lên 100 ° C :
100.4,18.(100 - 20) = 33440 (kJ)
Vì 20% nhiệt lượng đã toả ra môi trường nên nhiệt lượng mà khí thiên nhiên cần cung cấp phải là :
Đặt số mol C 2 H 6 tà x thì số mol C H 4 là 85. 10 - 1 x.
Ta có 1560x + 88085. 10 - 1 x = 41800
x = 462. 10 - 2
Thể tích khí thiên nhiên cần dùng:
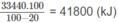




Khối lượng C có trong 5 kg than là:
mC =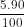 = 4,5 kg = 4500 gam
= 4,5 kg = 4500 gam
1 mol C = 12 gam
12g C cháy toả ra 394 kJ
Vậy 4500g C khi cháy toả ra x kJ
x =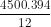 = 147750 kJ
= 147750 kJ
Khối lượng C có trong 5 kg than là:
mC =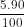 = 4,5 kg = 4500 gam
= 4,5 kg = 4500 gam
1 mol C = 12 gam
12g C cháy toả ra 394 kJ
Vậy 4500g C khi cháy toả ra x kJ
x =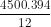 = 147750 kJ
= 147750 kJ