Hòa tan 29,4 gam đồng (II) hiđoxit bằng dung dịch axit clohidric 10,95% hãy tính khối lượng dung dịch axit clohidric đã dùng và nồng độ phần trăm dung dịch tạo thành sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cu(OH)2 + H2SO4 \(\rightarrow\) CuSO4 + 2H2O
nCu(OH)2 = \(\dfrac{29,4}{98}=0,3mol\)
Theo pt: nH2SO4 = nCu(OH)2 = 0,3 mol
=> mH2SO4 = 0,3.98 = 29,4g
VH2SO4 = 0,3:1 = 0,3l

PTHH: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
Ta có: \(n_{CuO}=\dfrac{29,4}{80}=0,3675\left(mol\right)=n_{CuSO_4}=n_{H_2SO_4}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CuSO_4}=0,3675\cdot160=58,8\left(g\right)\\m_{H_2SO_4}=0,3675\cdot98=36,015\left(g\right)\\V_{H_2SO_4}=\dfrac{0,3675}{1}=0,3675\left(l\right)=367,5\left(ml\right)\end{matrix}\right.\)

a) n Fe = 28/56 = 0,5(mol)
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH :
n HCl = 2n Fe = 1(mol)
=> m dd HCl = 1.36,5/10% = 365(gam)
b)
n FeCl2 = n H2 = n Fe = 0,5(mol)
Suy ra :
V H2 = 0,5.22,4 = 11,2(lít)
m FeCl2 = 0,5.127 = 63,5(gam)
c)
Sau phản ứng:
mdd = m Fe + mdd HCl - m H2 = 28 + 365 - 0,5.2 = 392(gam)
=> C% FeCl2 = 63,5/392 .100% = 16,2%

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(n_{HCl}=2n_{Zn}=0,4\left(mol\right)\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{14,6}{10,95\%}=\dfrac{400}{3}\left(g\right)\)
d, \(n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\)
Ta có: m dd sau pư = 13 + 400/3 - 0,2.2 = 2189/15 (g)
\(\Rightarrow C\%_{ZnCl_2}=\dfrac{0,2.136}{\dfrac{2189}{15}}.100\%\approx18,64\%\)
a.
PTHH:
Zn + 2HCl ---> ZnCl2 + H2
0.2 0.4 0.2 0.2 (mol)
b.
nZn=13/65=0.2(mol)
V H2 = 0.2*22.4 = 4.48 (l)
c.
mHCl=0.4*36.5=14.6(g)
mddHCl=14.6/10.95*100~133(g)
d.
mZn=0.2*35.5=7.1(g)
mZnCl2=0.2*106=21.2(g)
mH2=0.2*2=0.4(g)
Theo ĐLBTKL, ta có:
mZn + mddHCl = mddZnCl2 + mH2
7.1 + 133 = mddZnCl2 + 4
=> mddZnCl2= 7.1 + 133 - 4 = 136.1 (g)
S ZnCl2= 21.2/136.1*100 ~ 15 (g)

\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ a.Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{H_2}=n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\\ b.n_{HCl}=0,2.2=0,4\left(mol\right)\\ m_{ddHCl}=\dfrac{0,4.36,5.100}{7,3}=200\left(g\right)\\ c.m_{ddsau}=4,8+200-0,2.2=204,4\left(g\right)\\ C\%_{ddMgCl_2}=\dfrac{0,2.95}{204,4}.100\approx9,295\%\\ d.V_{ddHCl}=\dfrac{200}{1,05}=\dfrac{4000}{21}\left(ml\right)=\dfrac{4}{21}\left(l\right)\\ C_{MddHCl}=\dfrac{0,4}{\dfrac{4}{21}}=2,1\left(M\right)\)

Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,4 0,2 0,2
a) Số mol của axit clohidric
nHCl = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của axit clohidric
mHCl= nHCl . MHCl
= 0,4 . 36,5
= 14,6 (g)
Khối lượng của dung dịch axit clohidric cần dùng
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{14,6.100}{7,3}=200\left(g\right)\)
b) Số mol của muối sắt (II) clorua
nFeCl2 = \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Khối lượng của sắt (II) clorua
mFeCl2= nFeCl2 . MFeCl2
= 0,2 . 127
= 25,4 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mFe + mHCl - mH2
= 11,2 + 200 - ( 0,2 .2)
= 210,8 (g)
c) Nồng độ phần trăm của muối sắt (II) clorua
C0/0FeCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{25,4.100}{210,8}=12,05\)0/0
d) Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{7,3.300}{100}=21,9\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,6 0,3 0,3
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,6}{2}\)
⇒ Fe phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Fe
Sau phản ứng thu được muối FeCl2 và dung dịch HCl còn dư
Số mol của sắt (II) clorua
nFeCl2 = \(\dfrac{0,6.1}{2}=0,3\left(mol\right)\)
Khối lượng của sắt (II) clorua
mFeCl2 = nFeCl2 . MFeCl2
= 0,3 . 127
= 38,1 (g)
Số mol dư của dung dịch axit clohidric
ndư = nban đầu - nmol
= 0,6 - (0,2 . 2)
= 0,2 (mol)
Khối lượng dư của dung dịch axit clohidric
mdư = ndư. MHCl
= 0,2 . 36,5
= 7,3 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mFe + mHCl - mH2
= 11,2 + 300 - (0,3 . 2)
= 310,6 (g)
Nồng độ phần trăm của sắt (II) clorua
C0/0FeCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{38,1.100}{310,6}=12,27\)0/0
Nồng độ phần trăm của dung dịch axit clohdric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{7,3.100}{310,6}=2,35\)0/0
Chúc bạn học tốt
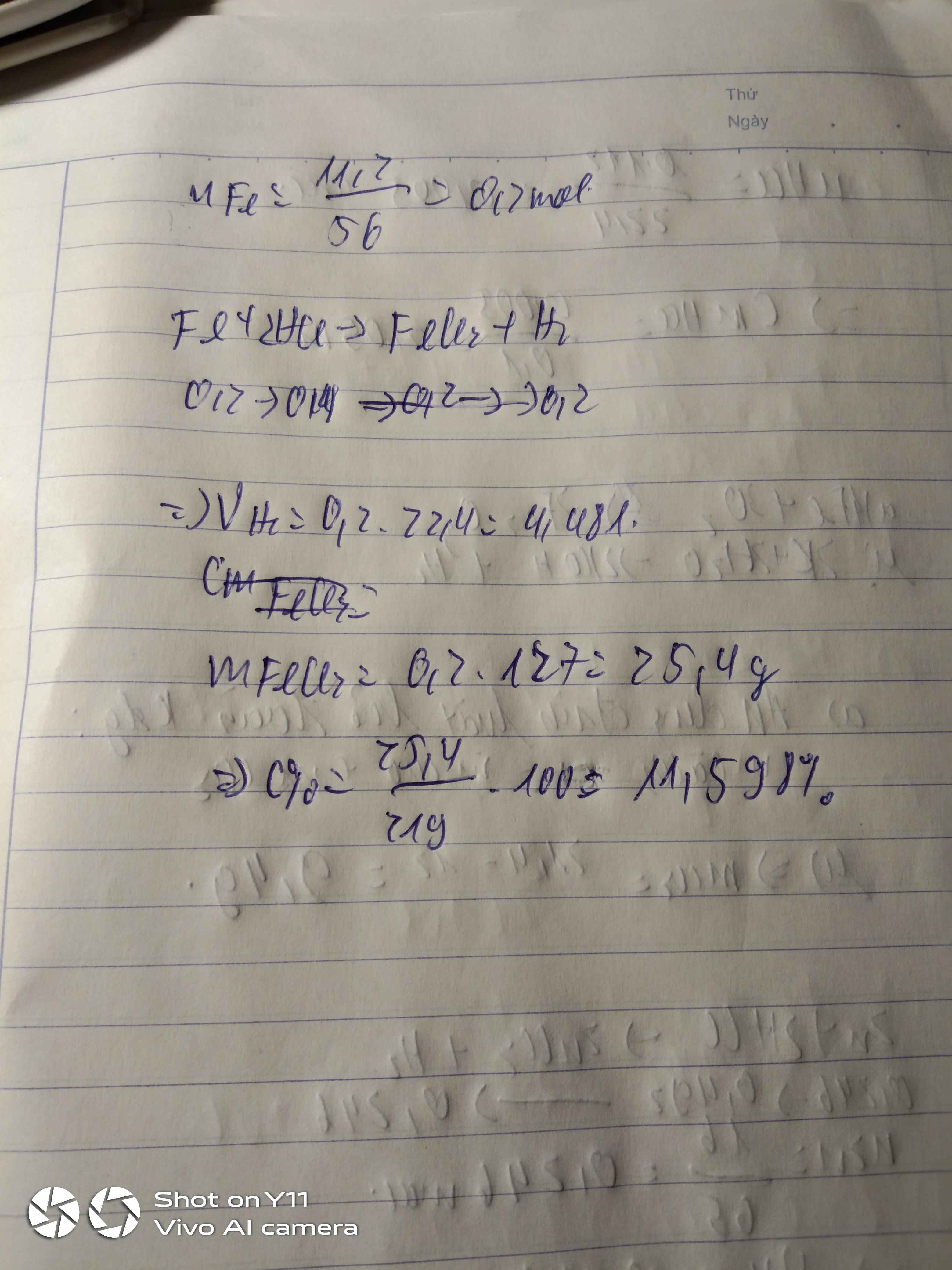
nCu(OH)2= 29,4/98=0,3(mol)
PTHH: Cu(OH)2 + 2 HCl -> CuCl2 + 2 H2O
0,3________0,6______0,3(mol)
mHCl=0,6.36,5=21,9(g)
=> mddHCl=(21,9.100)/10,95=200(g)
mddCuCl2= 29,4+200=229,4(g)
mCuCl2= 135. 0,3= 40,5(g)
=> C%ddCuCl2= (40,5/229,4).100=17,655%
Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{29,4}{80}=0,3675\left(mol\right)\)
Pt : CuO + 2HCl → CuCl2 + H2O\(|\)
1 2 1 1
0,3675 0,735 0,3675
Số mol của axit clohidric
nHCl = \(\dfrac{0,3675.2}{1}=0,735\left(mol\right)\)
Khối lượng của axit clohidric
mHCl = nHCl . MHCl
= 0,735 . 36,5
= 26,8275 (g)
Khối lượng của dung dịch axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{26,8275.100}{10,95}=\)245 (g)
Số mol của đồng (II) clorua
nCuCl2 = \(\dfrac{0,735.1}{2}=0,3675\left(mol\right)\)
Khối lượng của đồng (II) clorua
mCuCl2 = nCuCl2 . MCuCl2
= 0,3675 . 135
= 49,6125 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mCuO + mHCl
= 29,4 + 245
= 274,4 (g)
Nồng độ phần trăm của đồng (II) clorua
C0/0CuCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{49,6125.100}{274,4}=18,08\)0/0
Chúc bạn học tốt