Cho 5,5 gam hỗn hợp bột Al và Fe ( tỉ lệ mol 2:1) vào 330 ml dung dịch AgNO31M. Khuấy kĩ cho oharn ứng xẩy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
A. 33,95 gam
B. 35,20 gam
C. 39,35 gam
D. 35,39 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi nFe = x (mol) ⇒ nAl = 2nFe = 2x (mol)
mhỗn hợp= 56x + 2x. 27 = 5,5⇒ x = 0,05 (mol)⇒ nFe = 0,05 (mol), nAl = 0,1 (mol)
nAgNO3 = 0,3.1 = 0,3 (mol)
Viết PTHH có xảy ra theo thứ tự:
Al + 3AgNO3 → Al(NO3)3 + 3Ag↓ (1)
Fe + 3AgNO3 → Fe(NO3)2+ 3Ag↓ (2)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓ (3)
nAl = 0,1 (mol); nAgNO3 = 0,3 (mol) ⇒ chỉ xảy ra phản ứng (1). Không xảy ra phản ứng (2) và (3)
⇒m rắn = mAg↓ + mFe dư = 3*0,1*108 + 0,05*56 = 35,2 (g)

Đáp án : D
mAl + mFe = 5,5 và nAl =2nFe
=>nAl = 0,1 ; nFe = 0,05 mol
,nAgNO3 = 0,3 mol
Al + 3AgNO3 -> Al(NO3)3 + 3Ag
=> chất rắn gồm 0,3 molAg và 0,05 mol Fe
=> m = 35,2g

Đáp án B.
Các phương trình hóa học có thể xảy ra :
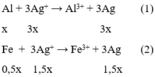
nAgNO3 = 0,3. 1 = 0,3 mol
Gọi số mol Al là x thì số mol Fe là 0,5x
Theo đề bài ta có: 27x + 56. 0,5x = 5,5 (1) suy ra x = 0,1 mol
Theo pt(1) nAgNO3 = 3. nAl = 3. 0,1 = 0,3 mol do đó chỉ xảy ra phản ứng (1).
Chất rắn thu được sau phản ứng là Ag và Fe
Khối lượng chất rắn = mAg + mFe = 0,3. 108 + 0,1. 0,5. 56 = 35,2 (g)

Do nAl : nFe = 2 : 1 và 27nAl + 56nFe = 7,15g
=> nAl = 0,13 mol ; nFe = 0,065 mol
nAgNO3 = 0,39 mol. Phản ứng xảy ra :
+/ Al + 3Ag+ → Al3+ + 3Ag
=>sau phản ứng có 0,39 mol Ag và 0,065 mol Fe
=> m = 45,76g
=>C

\(\left\{{}\begin{matrix}24n_{Mg}+27n_{Al}=10,5\\\dfrac{n_{Mg}}{n_{Al}}=\dfrac{1}{3}\end{matrix}\right.=>\left\{{}\begin{matrix}n_{Mg}=0,1\\n_{Al}=0,3\end{matrix}\right.\)
\(n_{CuCl_2}=0,25.1=0,25\left(mol\right)\)
PTHH: Mg + CuCl2 --> MgCl2 + Cu
0,1--->0,1----------------->0,1
2Al + 3CuCl2 --> 2AlCl3 + 3Cu
0,1<---0,15----------------->0,15
=> \(\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Cu}=0,25\left(mol\right)\end{matrix}\right.\)
=> m = 0,2.27 + 0,25.64 = 21,4 (g)
\(\left\{{}\begin{matrix}24.n_{Mg}+27.n_{Al}=10,5\\\dfrac{n_{Mg}}{n_{Al}}=\dfrac{1}{3}\end{matrix}\right.=>\left\{{}\begin{matrix}n_{Mg}=0,1\\n_{Al}=0,3\end{matrix}\right.\)
\(n_{CuCl_2}=0,25.1=0,25\left(mol\right)\)
PTHH: Mg + CuSO4 --> MgSO4 + Cu
0,1--->0,1-------->0,1------>0,1
2Al + 3CuSO4 --> Al2(SO4)3 + 3Cu
0,1<-0,15--------------------->0,15
=> \(\left\{{}\begin{matrix}n_{Al}=0,3-0,1=0,2\left(mol\right)\\n_{Cu}=0,25\left(mol\right)\end{matrix}\right.=>m=0,2.27+0,25.64=21,4\left(g\right)\)
Chọn B
Gọi số mol Fe là x => số mol Al là 2x
Ta có: 56x + 27.2x = 5,5 => x = 0,05;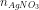 = 0,3.1 = 0,3 (mol)
= 0,3.1 = 0,3 (mol)
Al + 3Ag+ → Al3+ + 3Ag
0,1 0,3 0,3 (mol)
Vậy chất rắn thu được gồm Fe và Ag; m = 0,05.56 + 108.0,3 = 35,2 (gam).
Cho 5,5 gam hỗn hợp bột Al và Fe ( tỉ lệ mol 2:1) vào 330 ml dung dịch AgNO31M. Khuấy kĩ cho oharn ứng xẩy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
A. 33,95 gam
B. 35,20 gam
C. 39,35 gam
D. 35,39 gam