Có thể điều chế khí oxi trong phòng thí nghiệm bằng nhiều cách phân huỷ kali clorat hoặc kali pemanganat ở nhiệt độ cao giả sử lượng oxi thu được trong hai trừơng hợp là 3/1 viết pthh và tính tỷ lệ khối lượng kali clorat, kali pemangnat
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a.2KClO_3-^{t^o}\rightarrow2KCl+3O_2\\ n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,6\left(mol\right)\\ \Rightarrow V_{O_2}=0,6.22,4=13,44\left(l\right)\\ n_{KCl}=n_{KClO_3}=0,4\left(mol\right)\\ \Rightarrow m_{KCl}=0,4.74,5=29,8\left(g\right)\)

a) \(2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\)
b)
\(n_{KClO_3} = \dfrac{36,75}{122,5} = 0,3(mol)\)
Theo PTHH :
\(n_{KCl} = n_{KClO_3} = 0,3(mol)\\ \Rightarrow m_{KCl} = 0,3.74,5 = 22,35(gam)\\ \Rightarrow m_{O_2} = m_{KClO_3} - m_{KCl} = 14,4(gam)\)
c)
Bảo toàn khối lượng :
\(m_{O_2} = 25 - 15,4 = 9,6(gam)\\ \Rightarrow n_{O_2} = \dfrac{9,6}{32} = 0,3(mol)\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = 0,2(mol)\\ \Rightarrow m_{KClO_3} = 0,2.122,5 = 24,5(gam)\\ \%m_{tạp\ chất}= \dfrac{25-24,5}{25}.100\% = 2\%\)
\(a.\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(b.\)
\(n_{KClO_3}=\dfrac{36.75}{122.5}=0.3\left(mol\right)\)
\(\Rightarrow n_{O_2}=\dfrac{3}{2}n_{KClO_3}=\dfrac{3}{2}\cdot0.3=0.45\left(mol\right)\)
\(m_{O_2}=0.45\cdot32=14.4\left(g\right)\)
\(m_{KCl}=0.3\cdot74.5=22.35\left(g\right)\)
\(c.\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(a.............a\)
\(m_{Cr}=m_{KCl}+m_{tc}=25-122.5a+74.5a=15.4\left(g\right)\)
\(\Rightarrow a=0.2\)
\(m_{O_2}=\dfrac{3}{2}\cdot0.2\cdot32=9.6\left(g\right)\)
\(m_{KClO_3}=0.2\cdot122.5=24.5\left(g\right)\)
\(m_{tc}=25-24.5=0.5\left(g\right)\)
\(\%m_{Tc}=\dfrac{0.5}{25}\cdot100\%-2\%\)

a.\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
2 2 3 ( mol )
0,1 0,15
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)
b.\(V_{kk}=V_{O_2}.5=3,36.5=16,8l\)
c.\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{28}{56}=0,5mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
3 2 1 ( mol )
0,5 > 0,15 ( mol )
0,225 0,15 ( mol )
\(m_{Fe\left(du\right)}=n_{Fe\left(du\right)}.M_{Fe}=\left(0,5-0,225\right).56=15,4g\)

\(n_{KClO_3\left(bd\right)}=\dfrac{55,125}{122,5}=0,45\left(mol\right)\)
=> \(n_{KClO_3\left(pư\right)}=\dfrac{0,45.85}{100}=0,3825\left(mol\right)\)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
0,3825------------------->0,57375
=> \(V_{O_2}=0,57375.22,4=12,852\left(l\right)\)

a) Do khí oxi thu được hao hụt 10% nên hiệu suất phản ứng là 90%.
Thể tích khí oxi thu được là:
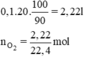
Phương trình hóa học của phản ứng nhiệt phân KMnO4:
2KMnO4 -to→ O2 + K2MnO4 + MnO2.
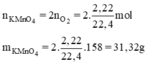
b) Ý b) tách biệt so với ý a), ngoài ra ở ý b) không cho lượng oxi hao hụt là bao nhiêu nên ta lấy hiệu suất phản ứng đạt 100%.
Thể tích khí oxi thu được là: V = 0,1.20 = 2 (lít)


a, PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
Theo PT: \(n_{Fe}=3n_{Fe_3O_4}=0,03\left(mol\right)\Rightarrow m_{Fe}=0,03.56=1,68\left(g\right)\)
\(n_{O_2}=2n_{Fe_3O_4}=0,02\left(mol\right)\Rightarrow m_{O_2}=0,02.32=0,64\left(g\right)\)
b, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,04\left(mol\right)\Rightarrow m_{KMnO_4}=0,04.158=6,32\left(g\right)\)

a. \(n_{Fe_3O_4}=\dfrac{2.32}{232}=0,01\left(mol\right)\)
\(3Fe+2O_2\rightarrow Fe_3O_4\)
0,03 ..0,02 ...... 0,01 (mol)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe}=0,03.56=1,68\left(g\right)\\V_{O_2}=0,02.22,4=0,448\left(l\right)\end{matrix}\right.\)
\(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
0,04 ------------------------------------ 0,02 (mol)
\(\rightarrow m_{KMnO_4}=0,04.158=6,32\left(g\right)\)
a)PTHH: 3Fe+2O2__>Fe3O4
SỐ MOL OXIT SẮT TỪ:2.32/232=0.1MOL
THEO PT:
- ĐỂ TẠO RA 1 MOL Fe3O4 CẦN 2 MOL O2 VẬY ĐỂ TẠO RA 0.1 MOL Fe3O4 CẦN 0.2 MOL O2
- ĐỂ TẠO RA 1 MOL Fe3O4 CẦN 3 MOL Fe VẬY ĐỂ TẠO RA 0.1 MOL Fe3O4 CẦN 0.3 MOL Fe
=>SỐ GAM Fe CẦN: 0.3x56=16.8 g
-THỂ TÍCH KHÍ O2 CẦN: 0.2x22.4=4.48 l
b) PTHH: 2KMnO4 __>MnO2+O2+K2MnO4
Theo PT,để tạo 1 mol O2 cần 2 mol KMnO4
⇒để tạo ra 0.2 mol O2(cần dùng) thì cần 0.4 mol KMnO4
⇒ số g KMnO4 cần là:158*0.4=63.2
P/S: đúng thì nhớ tích vào đấy

Phương trình phản ứng khi phân huỷ kali clorat là:
2KClO3 → 2KCl + 3O2
Phương trình phản ứng khi phân huỷ kali pemanganat là:
2KMnO4 → K2MnO4 + MnO2 + 3O2
Theo đó, ta có thể tính tỷ lệ khối lượng giữa hai chất như sau:
Giả sử khối lượng kali clorat cần để thu được 3 mol oxi là x gram.
Theo phương trình phản ứng, 2 mol KClO3 tạo ra 3 mol O2, nên khối lượng KClO3 cần để thu được 3 mol O2 là (2/3)x gram.
Tỷ lệ khối lượng giữa KClO3 và O2 là:
(2/3)x : x = 2 : 3
Từ đó, ta có:
x = (3/2)(2/3)x
x = 1.5(2/3)x
x = 1.0x
Vậy, tỷ lệ khối lượng giữa KClO3 và O2 là 2 : 3.
Tương tự, giả sử khối lượng kali pemanganat cần để thu được 3 mol oxi là y gram.
Theo phương trình phản ứng, 2 mol KMnO4 tạo ra 3 mol O2, nên khối lượng KMnO4 cần để thu được 3 mol O2 là (2/3)y gram.
Tỷ lệ khối lượng giữa KMnO4 và O2 là:
(2/3)y : y = 2 : 3
Từ đó, ta có:
y = (3/2)(2/3)y
y = 1.5(2/3)y
y = 1.0y
Vậy, tỷ lệ khối lượng giữa KMnO4 và O2 cũng là 2 : 3.