Nếu hàm lượng % của kim loại R trong muối cacbonat là 40% thì hàm lượng % của kim loại R trong muối photpho là bao nhiêu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


gọi A là kim loại đó, x là hóa trị của kim loại A, và M là nguyên tử khối của A
công thức muối cacbonat của A là A2(CO3)x
công thức hàm lượng % của A là 2M / ( 2M + 60x ) = 0.4
từ pt này bạn tính M theo x ra M = 20x
công thức muối photphat của A là A3(PO4)x
hàm lượng % của M là 3M / ( 3M + 95x)
Lấy M=20x thế vào triệt tiêu x ra đáp án là 60/155=38,71%

\(CTTQ:X_2\left(CO_3\right)_n\\ Vì:\%m_X=40\%\\ \Leftrightarrow\dfrac{2M_X}{2M_X+60n}.100\%=40\%\\ \Leftrightarrow60n=60\%M_{hc}\\ \Leftrightarrow M_{hc}=100n\)
Xét các TH n=1; n=2; n=3 ; n=8/3
=>Chọn n=2 => CTTQ: XCO3 => X: Canxi (Ca)

tham khảo
Coi mdd H2SO4=100(gam)mdd H2SO4=100(gam)
⇒nH2SO4=100.9,8%98=0,1(mol)⇒nH2SO4=100.9,8%98=0,1(mol)
Gọi CTHH của muối cacbonat kim loại R hóa trị n là R2(CO3)nR2(CO3)n
R2(CO3)n+nH2SO4→R2(SO4)n+nCO2+nH2OR2(CO3)n+nH2SO4→R2(SO4)n+nCO2+nH2O
Theo phương trình ,ta có :
nCO2=nH2SO4=0,1(mol)nCO2=nH2SO4=0,1(mol)
nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)
Sau phản ứng ,
mdd=0,1n(2R+60n)+100−0,1.44=0,2Rn+101,6(gam)mdd=0,1n(2R+60n)+100−0,1.44=0,2Rn+101,6(gam)
mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)
⇒C%muối=(0,2Rn+9,6):(0,2Rn+101,6).100%=14,18%⇒C%muối=(0,2Rn+9,6):(0,2Rn+101,6).100%=14,18%
⇒R=28n⇒R=28n
Với n=1n=1 thì R=28R=28(loại)
Với n=2n=2 thì R=56(Fe)R=56(Fe)
Với n=3n=3 thì R=84R=84(loại)
Vậy kim loại R hóa trị n là FeFe hóa trị II

1. CO3 = 12+ 16.3 = 60g
kim loại đó mkl = 40% = 40g = Ca
PO4 = 31 + 16.4 = 95
% Ca = 40/(95+40).100% = 29,6%
2. % Fe trong fe0 = 56/(56+16) = 77,41%
vay nó là FeO

CTHH muối cacbonat: R2(CO3)n
CTHH muối photphat: R3(PO4)n
Xét R2(CO3)n
\(\%R=\dfrac{2.M_R}{2.M_R+60n}.100\%=40\%\)
=> 2.MR = 0,8.MR + 24n
=> 1,2.MR = 24n
=> \(M_R=20n\) (g/mol)
Xét R3(PO4)n
\(\%R=\dfrac{3.M_R}{3.M_R+95n}.100\%=\dfrac{3.20n}{3.20n+95n}.100\%=38,71\%\)

R chiếm 40 % về khối lượng
=> \(40=\dfrac{R.100}{R+60}\)
=> R = 40
Vậy R là canxi (Ca)
CTHH của muối: CaCO3

\(\dfrac{R.100\%}{R+60}=40\%\)\(\Rightarrow R=40\left(Ca\right)\)
\(\Rightarrow\%Ca\left(trongCa_3PO_4\right)=\dfrac{40.3.100}{40.3+31+16.4}=55,81\%\)

Đáp án C
Gọi công thức của hai muối trong hỗn hợp ban đầu là A2CO3 và BCO3.
Có các phản ứng:
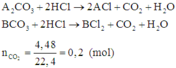
Quan sát phản ứng thấy khi cho hỗn hợp phản ứng với dung dịch HCl thì mỗi gốc C O 3 2 - trong muối được thay thế bởi hai gốc Cl-.
Có 1 mol C O 3 2 - bị thay thế bởi 2 mol Cl- thì khối lượng của muối tăng: (2.35,5 -60) = 11(gam)
Do đó khối lượng muối khan thu được khi cô cạn dung dịch là:
mmuối clorua = mmuối cacbonat + 0,2.11 = 23,8 + 0,2.11= 26 (gam)
Đặt CTHH của muối cacbonat của kim loại R là \(R_2\left(CO_3\right)_n\)
Ta có: hàm lượng % của kim loại R trong muối cacbonat là 40%
=> \(40=\dfrac{2R.100}{2R+60n}\)
=> 20n = R
- Sau khi lập bảng trên ta thấy, n = 2 thì R = 40 (Ca)
=> CTHH của muối cacbonat đó là CaCO3
- CTHH của kim loại R (tức là Ca) trong muối cacbonat là: Ca3(PO4)2
- Hàm lượng % của kim loại Ca trong muối photphat là
\(\%Ca=\dfrac{3.40.100}{40.3+95.2}=38,71\%\)
Cho mình hỏi ngu tí từ đoạn 40 =... làm sao suy ra đc 20n =R vậy? Cảm ơn bạn nhiều