a) Lấy chính xác 100ml dd H2SO4 0,2M và cho nước cất đến vạch 250ml. Tính nồng độ đương lượng của dung dịch mới và số gam H2SO4 có trong 10 ml dung dịch này. b) Tính nồng độ dung dịch HNO3 thu được khi trộn: • 500 g HNO3 10 % với 300 g HNO3 20% • 600 ml HNO3 2 N với 200 ml HNO3 4 N
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1ml dung dịch cho khối lượng 1,05 gam
200 ml dung dịch cho khối lượng m dd = 210 gam
Nồng độ phần trăm:
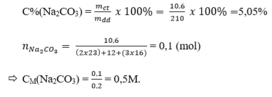

1ml dung dịch cho khối lượng 1,05 gam
200 ml dung dịch cho khối lượng mdd = 210 gam
Nồng độ phần trăm:
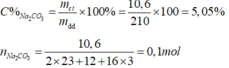
C M Na 2 CO 3 = 0 , 1 : 0 , 2 = 0 , 5 M .

Ta có: nMg = 4,8 : 24 = 0,2 mol
a)PTHH:
Mg + H2SO4 → MgSO4 + H2
Theo tỉ lệ phản ứng => nH2SO4 phản ứng = nMgSO4 = nH2 = 0,2 mol
=> VH2 = 0,2.22,4 = 4,48 lít.
Bài 38 :
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(m_{dd}=1,176.250=294\left(g\right)\)
\(m_{ct}=\dfrac{294.10}{100}=29,4\left(g\right)\)
\(n_{H2SO4}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
Pt : \(Mg+H_2SO_4\rightarrow MgSO_4+H_2|\)
1 1 1 1
0,2 0,3 0,2 0,2
a) Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\)
⇒ Mg phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của Mg
\(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
b) \(n_{MgSO4}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{MgSO4}=0,2.120=24\left(g\right)\)
\(n_{H2SO4\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\)
⇒ \(m_{H2SO4\left(dư\right)}=0,1.98=9,8\left(g\right)\)
Sau phản ứng :
\(m_{dd}=4,8+294-\left(0,2.2\right)=298,4\left(g\right)\)
\(C_{MgSO4}=\dfrac{24.100}{298,4}=8,04\)0/0
\(C_{H2SO4\left(dư\right)}=\dfrac{9,8.100}{298,4}=3,28\)0/0
Chúc bạn học tốt

a) Ta có: \(n_{Al\left(NO_3\right)_3}=\dfrac{4,26}{213}=0,02\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al^+}=0,02\left(mol\right)\\n_{NO_3^-}=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\left[Al^+\right]=\dfrac{0,02}{0,1}=0,2\left(M\right)\\\left[NO_3^-\right]=\dfrac{0,06}{0,1}=0,6\left(M\right)\end{matrix}\right.\)
b) Ta có: \(\left[Na^+\right]=0,1+0,02\cdot2+0,3=0,304\left(M\right)\)
c) Bạn xem lại đề !!

a, \(n_{NaOH}=0,2.1=0,2\left(mol\right)\)
\(m_{NaOH}=0,2.40=8\left(g\right)\)
b, \(n_{H_2SO_4}=2.0,1=0,2\left(mol\right)\)
\(c,C\%=\dfrac{6}{200}.100\%=3\%\)
\(m_{NaCl}=\dfrac{200.8}{100}=16\left(g\right)\)