cho mg hỗn hợp chứa 0,1 mol Cu và 0,1 mol Fe3O4 vào dung dịch chứa HCl vueaf đủ thu được dung dịch X . cho AgNO3 dư vào X thu đc a g kết tủa . giá trị của a là :( đáp án là 147,2g)
giải chi tiết hộ mk vs
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sau phản ứng dung dịch chứa 0,1 mol $Cu^{2+}$ và 0,3 mol $Fe^{2+}$
Bảo toàn điện tích ta có: $n_{Cl^-}=0,8(mol)$
Phản ứng với AgNO3 thì thu được 0,8 mol $AgCl$ và 0,3 mol $Ag$
$\Rightarrow a=147,2(g)$
Lượng HCl vừa đủ hòa tan Fe3O4 ⇒nHCl=8nFe3O4=0,8(mol)⇒nHCl=8nFe3O4=0,8(mol)
Sau phản ứng sinh ra 0,1 mol FeCl2 và 0,2 mol FeCl3
0,2 mol FeCl3 hòa tan vừa hết 0,1 mol Cu
+)
Cho AgNO3 vào dd X thì xảy ra phản ứng đẩy kim loại trong muối tạo Ag và phản ứng tạo kết tủa AgCl
Bảo toàn e, ta có: nAg↓=2nCu+nFe3O4=0,3(mol)nAg↓=2nCu+nFe3O4=0,3(mol)
Bảo toàn nguyên tố, ta có: nAgCl↓=nHCl=0,8(mol)nAgCl↓=nHCl=0,8(mol)
Vậy khối lượng kết tủa sau cùng là:
m↓=108nAg↓+143,5nAgCl↓=147,2(g)

Chọn đáp án C
Ta có :![]()
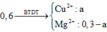
Vậy 9,36 chất rắn là gì ?
Đương nhiên là Fe và Cu
![]()
![]()
![]()

Chọn B.
Dung dịch X chứa Mg(NO3)2 và Cu(NO3)2 . Khi cho X tác dụng với Fe thì:
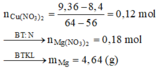

Dung dịch X chứa Mg(NO3)2 (a mol) và Cu(NO3)2 dư (b mol)
Bảo toàn N => 2a + 2b = 0,1 + 0,25.2
X với Fe: ∆ m = 64b - 56b = 9,36 - 8,4
Giải hệ được a = 0,18 và b = 0,12
Trong 19,44 gam kết tủa chứa Ag (0,1), Cu
(0,25 - 0,12 = 0,13) => mMg dư = 0,32
m = 0,18.24 + 0,32 = 4,64
Đáp án C

Y chứa 3 kim loại thì 3 kim loại đó gồm Ag, Cu, Fe.
Thứ tự các phản ứng:

Đáp án B


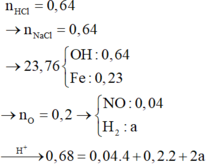

+)
Lượng HCl vừa đủ hòa tan Fe3O4 \(\Rightarrow n_{HCl}=8n_{Fe3O4}=0,8\left(mol\right)\)
Sau phản ứng sinh ra 0,1 mol FeCl2 và 0,2 mol FeCl3
0,2 mol FeCl3 hòa tan vừa hết 0,1 mol Cu
+)
Cho AgNO3 vào dd X thì xảy ra phản ứng đẩy kim loại trong muối tạo Ag và phản ứng tạo kết tủa AgCl
Bảo toàn e, ta có: \(n_{Ag\downarrow}=2n_{Cu}+n_{Fe3O4}=0,3\left(mol\right)\)
Bảo toàn nguyên tố, ta có: \(n_{AgCl\downarrow}=n_{HCl}=0,8\left(mol\right)\)
Vậy khối lượng kết tủa sau cùng là:
\(m_{\downarrow}=108n_{Ag\downarrow}+143,5n_{AgCl\downarrow}=147,2\left(g\right)\)