Đốt cháy 8,1 gam nhôm trong không khí, sau phản ứng thu được 12,24 gam chất rắn D.
a/ Tính thể tích không khí (đktc) đã phản ứng, biết O2 chiếm 20% thể tích không khí.
b/ Tính hiệu suất của phản ứng trên.
c/ Hòa tan hỗn hợp D trong dung dịch HCl. Tính khối lượng HCl cần dùng để phản ứng.
em cần gấp, mọi người giúp em với huhu

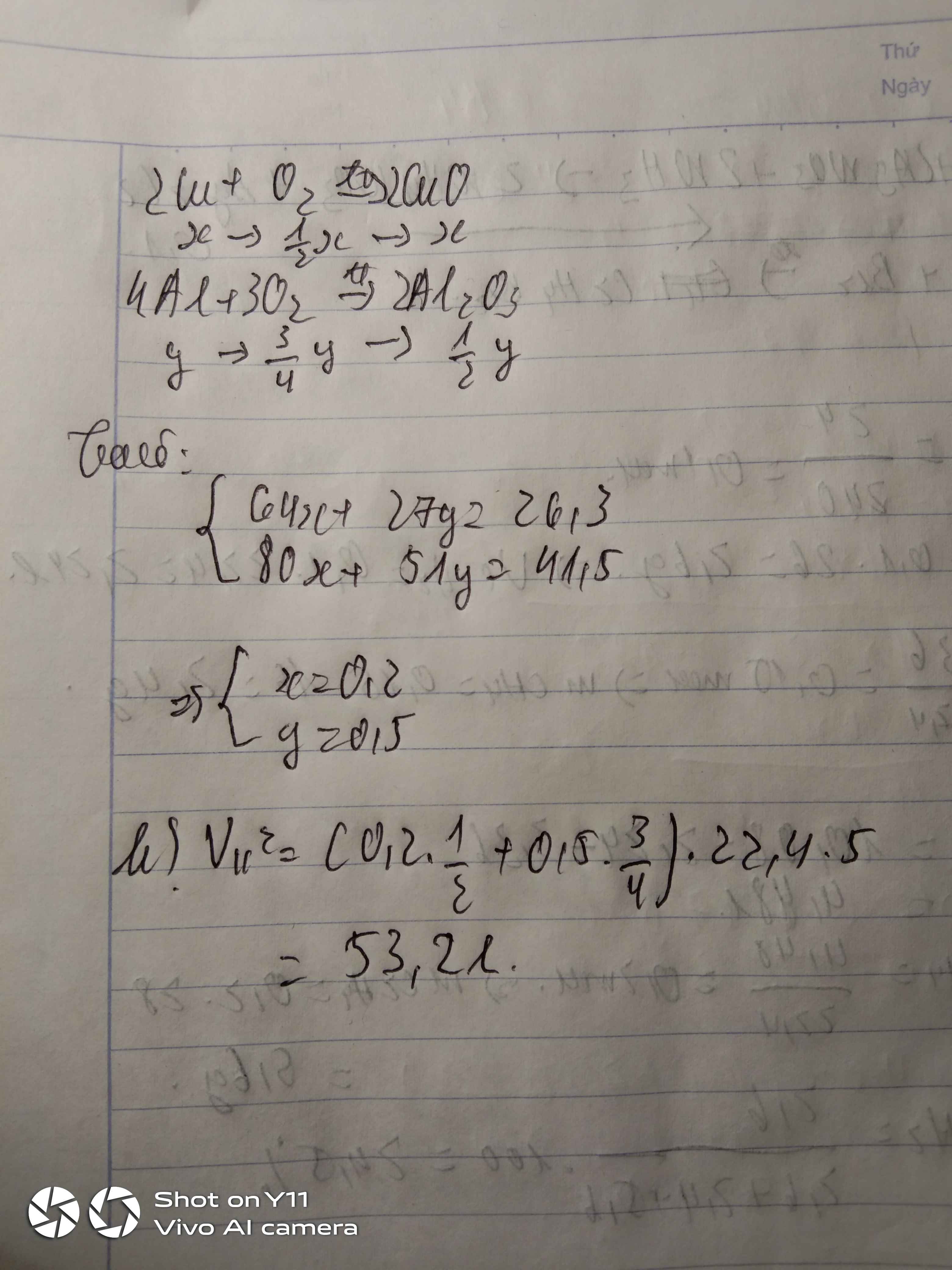
a) \(4Al+3O_2-^{t^o}\rightarrow2Al_2O_3\)
Bảo toàn khối lượng : \(m_{O_2}=12,24-8,1=4,14\left(g\right)\)
=>\(n_{O_2}=\dfrac{207}{1600}\left(mol\right)\)
Vì O2 chiếm 20% thể tích không khí
\(V_{kk}=\dfrac{\dfrac{207}{1600}.22,4}{20\%}=14,49\left(lít\right)\)
b) \(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
Lập tỉ lệ : \(\dfrac{0,3}{4}>\dfrac{\dfrac{207}{1600}}{3}\)
=> Sau phản ứng Al dư
\(n_{Al\left(pứ\right)}=\dfrac{207}{1600}.\dfrac{4}{3}=0,1725\left(mol\right)\)
=> \(H=\dfrac{0,1725}{0,3}.100=57,5\%\)
c) D gồm Al2O3 và Al dư
\(n_{Al_2O_3}=\dfrac{2}{3}n_{O_2}=\dfrac{69}{800}\left(mol\right);n_{Al\left(dư\right)}=0,3-0,1725=0,1275\left(mol\right)\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Sigma n_{HCl}=\dfrac{69}{800}.6+0,1275.3=0,9\left(mol\right)\)
=> \(m_{HCl}=0,9.36,5=32,85\left(g\right)\)