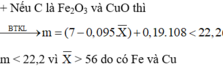cho NaOH dư vào dung dịch chứa 9,14 gam hỗn hợp MgCl2 và AlCl3 . lọc kết tủa và nung đến khối lượng không đổi thu được 1,6 gam chất rắn . khối lượng AlCl3 trog hỗn hợp ban đầu là bao nhiêu ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


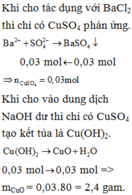
n MgCl2 = a(mol) ; n ZnSO4 = b(mol)
=> 95a + 161b = 67,3(1)
MgCl2 + 2KOH → Mg(OH)2 + 2KCl
ZnSO4 + 2KOH → Zn(OH)2 + 2KCl
Zn(OH)2 + 2KOH → K2ZnO2 + 2H2O
$Mg(OH)_2 \xrightarrow{t^o} MgO + H_2O$
=> 40a = 8(2)
Từ (1)(2) suy ra a = 0,2 ; b = 0,3
=>m ZnSO4 = 0,3.161 = 48,3 gam

Đáp án A
3NH3+ AlCl3+ 3H2O → 2Al(OH)3+3 NH4Cl (1)
2NH3+ CuCl2+ 2H2O → Cu(OH)2+2 NH4Cl (2)
4NH3+ Cu(OH)2 → [Cu(NH3)4](OH)2 (3)
Do NH3 dư nên sau phản ứng chỉ thu được kết tủa Al(OH)3
2Al(OH)3 → t o Al2O3+ 3H2O (3)
Có: nAl(OH)3= nAlCl3= 0,2 mol → nAl2O3= 0,1 mol
→ mAl2O3= 0,1.102=10,2 gam

Đáp án B
Fe3++ 3OH- → Fe(OH)3
0,1 mol 0,1 mol
Al3++ 3OH- → Al(OH)3
Zn2++ 2OH- → Zn(OH)2
Do Al(OH)3 và Zn(OH)2 là hidroxit lưỡng tính nên bị tan trong NaOH dư
Kết tủa thu được có Fe(OH)3
2Fe(OH)3 → Fe2O3+ 3H2O
0,1 0,05 mol
mFe2O3 = 0,05.160 = 8 gam