Viết công thức tính thành phần phần trăm theo khối lượng của 1 nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khối lượng mol :
MKMnO4 = 39 + 55 + 64 = 158 (g/mol)
Số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất :
nK = 1 mol
nMn = 1 mol
nO = 4 mol
Khối lượng của mỗi nguyên tố có trong 1 mol hợp chất :
mK = 39.1 = 39 (g)
mMn = 55.1 = 55 (g)
mO = 16.4 = 64 (g)
Thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất :
\(\%m_K=\frac{m_K}{M_{KMnO_4}}.100\%=\frac{39}{158}.100\%=24,7\%\)
\(\%m_{Mn}=\frac{m_{Mn}}{M_{KMnO_4}}.100\%=\frac{55}{158}.100\%=34,8\%\)
\(\%m_O=\frac{m_O}{m_{KMnO_4}}.100\%=\frac{64}{158}.100\%=40,5\%\)
Các bước giải bài toán xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất :
B1 : Tính khối lượng mol (M) của hợp chất.
B2 : Tính số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất.
B3 : Tính khối lượng của mỗi nguyên tố có trong 1 mol hợp chất.
B4 : Tính thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất.

Ta có CTTH: KClO3
=> Gọi CTTQ là K1Cl1O3
=> \(M_{KClO_3}=122,5\) (g/mol)
\(\%m_K=\dfrac{1
.
39}{122,5}
.
100\%=31,84\%\)
\(\%m_{Cl}=\dfrac{1
.
35,5}{122,5}
.
100\%=28,98\%\)
\(\%m_O=100\%-\left(\%m_K+\%m_{Cl}\right)=100\%-\left(31,84\%+28,98\%\right)=39,18\%\)
Phần trăm K trong KClO3: \(\%K=\dfrac{39}{39+35,5+16.3}.100=31,84\%\)
Phần trăm Cl trong KClO3: \(\%Cl=\dfrac{35,5}{39+35,5+16.3}.100=28,98\%\)
Phần trăm O trong KClO3: \(\%O=100-31,84-28,98=39,18\%\)

Các bước giải :
B1 : Tìm khối lượng của mỗi nguyên tố có trong 1 mol hợp chất.
B2 : Tìm số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất.
B3 : Lập CTHH.

a) CTHH: \(H_xS\)
Ta có : \(\dfrac{32}{x+32}=94,12\%\Rightarrow x=2\)
=> CTHH: \(H_2S\)
Ý nghĩa : hợp chất được tạo từ 2 nguyên tố H, S
Trong 1 phân tử chất có 1 nguyên tử H và 2 nguyên tử S
Phân tử khối của hợp chất là 2 + 32 = 34 đvC
b) Gọi CTHH của hợp chất là \(Na_xAl_yO_z\)
Ta có : \(x:y:z=\dfrac{28}{23}:\dfrac{33}{27}:\dfrac{39}{16}=1:1:2\)
Vậy CTHH của hợp chất là \(NaAlO_2\)
Sửa : Trong 1 phân tử chất có 2 nguyên tử H và 1 nguyên tử S

Các bước giải :
B1 : Tính khối lượng mol của hợp chất.
B2 : Tính số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất.
B3 : Tính khối lượng của mỗi nguyên tố có trong 1 mol hợp chất.
B4 : Tính thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất.
Các bước giải:
Bước 1:Tính khối lượng M của hợp chất.
Bước 2 :Tính số M nguyên tử của mỗi nguyên tố có trong 1 M hợp chất.
Bước 4:Tính phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất.
☆♡CHÚC BẠN HỌC TỐT♡☆
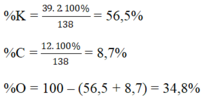
Nếu biết công thức của hợp chất ta có thể tính thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất đó theo các bước sau:
- Tính khối lượng mol của hợp chất AxBy:
- Xác định số mol nguyên tử của từng nguyên tố có trong 1 mol hợp chất AxBy.
1 mol AxBy có: x mol nguyên tử A và y mol nguyên tử B.
- Tìm khối lượng các nguyên tố trong 1 mol hợp chất AxBy.
mA=x.MA
mB=y.MB
- Tính phần trăm theo khối lượng của từng nguyên tố theo công thức:
%A= mA .100%= .100%
%B= .mB . 100%= .100%
Hoặc %B=100%-%A
Theo mình còn có một cách khác có thể giải tất cả dạng bài kiểu này
B1 : Gọi CTHH cần tìm la AxByCz
B2 : Ta có : x: y :z = %A/ MA : %B / MB : %C/ MC = a :b :c
B3 Chọn x=a ; y=b ; z=c
B4 Đưa ra công thức đơn giản AaBbCc
B5 Dựa vào PTK đưa ra CT phân tử
Làm tương tự với các bài hpas chỉ có 2 nguyên tố hóa học
Chúc bạn học tốt nha