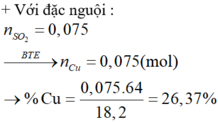Cho m (g) hỗn hợp X gồm Fe và S tác dụng hết vs dung dịch HCl thu được 5,6 (l) H2 ở điều kiện tiêu chuẩn. Cũng cho m (g) hỗn hợp trên tác dụng vs NaOH (dư) thì sau phản ứng còn 5,6 (g) chất rắn. Tính % khối lượng các kim loại trong hỗn hợp X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nH2 = 0,672/22,4 = 0,03 (mol)
PTHH: Fe + 2HCl -> FeCl2 + H2
nFe = 0,03 (mol)
mFe = 0,03 . 56 = 1,68 (g)
mCu = 2,96 - 1,68 = 1,28 (g)
nCu = 1,28/64 = 0,02 (mol)
PTHH:
2Fe + 3Cl2 -> (t°) 2FeCl3
0,03 ---> 0,045
Cu + Cl2 -> (t°) CuCl2
0,02 ---> 0,02
nCl2 = 0,045 + 0,02 = 0,065 (mol)
VCl2 = 0,065 . 22,4 = 1,456 (l)

Fe+2HCl->FeCl2+H2
0,02-0,04--------------0,02
Fe2O3+6HCl->2Fecl3+3H2O
0,03-----0,18 mol
n H2=\(\dfrac{0,448}{22,4}\)=0,02 mol
=>m Fe=0,02.56=1,12g
=>m Fe2O3=4,8g=>n Fe2O3=\(\dfrac{4,8}{160}\)=0,03 mol
=>x=CMHCl=\(\dfrac{0,22}{0,5}\)=0,44M
b)
2Fe+3Cl2-to>2FeCl3
0,02---0,03
=>m Cl2=0,03.71=2,13g

Fe không tác dụng với H2SO4 đặc nguội
=> mFe = 5,6 (g)
Gọi số mol Mg, Cu là a, b (mol)
=> 24a + 64b = 14,4 - 5,6 = 8,8 (1)
\(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Mg + 2H2SO4 --> MgSO4 + SO2 + H2O
a---------------------------->a
Cu + H2SO4 --> CuSO4 + SO2 + H2O
b--------------------------->b
=> a + b = 0,2 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
\(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{14,4}.100\%=38,89\%\\\%m_{Mg}=\dfrac{0,1.24}{14,4}.100\%=16,67\%\\\%m_{Cu}=\dfrac{0,1.64}{14,4}.100\%=44,44\%\end{matrix}\right.\)

Sửa đề: 6,4 gam hh \(\rightarrow\) 6,45 gam hh
a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+27b=6,45\) (1)
Ta có: \(n_{H_2}=\dfrac{7,28}{22,4}=0,325\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,65\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{Mg}=0,1\left(mol\right)\\b=n_{Al}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1\cdot24}{6,4}\cdot100\%=37,5\%\\\%m_{Mg}=62,5\%\end{matrix}\right.\)
b) Ta thấy với 6,45 gam hh thì có 0,1 mol Mg và 0,15 mol Al
\(\Rightarrow\) Trong 12,9 gam hh thì chứa 0,2 mol Mg và 0,3 mol Al
Gọi \(n_{SO_2}=x\left(mol\right)\)
Bảo toàn electron: \(2\cdot0,2+3\cdot0,3=2x\) \(\Rightarrow x=n_{SO_2}=0,65\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,65\cdot22,4=14,56\left(l\right)\)
gọi số mol của Mg là x mol ; Al là y mol => 24x + 27y =6,4
n khí = 7,28/22,4=0,325 mol
bảo toàn e ta có
Mg + H2SO4 --> MgSO4 + H2
x x mol
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
y 3/2 y mol
=> x + 3/2y=0,325
=> x=11/120 mol ; y=7/45 mol
=> mMg11/120*24=2,2g => %mMg = 2,2*100/6,4=34,375%
=>%mAl=100-34,375=65,625%