a) Đun nóng nhẹ dung dịch HCl đậm đặc dư với 3,48 gam MnO2, khí Clo sinh ra được hấp thụ hết bằng 800 ml dung dịch NaOH 0,1M ở nhiệt độ thường. Tính nồng độ mol/l của các chất trong dung dịch sau phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


MnO 2 + HCl → MnCl 2 + Cl 2 + 2 H 2 O
Cl 2 + 2NaOH → NaCl + NaClO + H 2 O
n MnO 2 = 0,2 mol; n NaOH = 0,729 mol
Theo phương trình (1) ta có: n Cl 2 = n MnO 2 = 0,2 mol
Theo phương trình (2) ta có: 2 n Cl 2 < n NaOH ⇒ NaOH dư
Dung dịch A gồm: n NaCl = n NaClO = n Cl 2 = 0,2 mol
n NaOH dư = 0,729 – 2.0,2 = 0,329 mol
m dd A = m Cl 2 + m dd NaOH = 0,2.71 + 145,8 = 160g
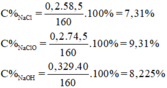

Phản ứng xảy ra:
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
Ta có:
\(n_{MnO2}=\frac{13,05}{55+16.2}=0,15\left(mol\right)\)
\(\Rightarrow n_{Cl2}=n_{MnO2}=0,15\left(mol\right)\)
\(2NaOH+Cl_2\rightarrow NaCl+NaClO+H_2O\)
Vì \(n_{NaOH}=0,5.1=0,5\left(mol\right)>2nCl_2\)
Nên NaOH dư.
\(\Rightarrow n_{NaCl}=n_{NaClO}=n_{Cl2}=0,15\left(mol\right)\)
\(n_{NaOH\left(Dư\right)}=0,5-0,15.2=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}CM_{NaCl}=\frac{0,15}{0,5}=0,3M\\CM_{NaClO}=\frac{0,15}{0,5}=0,3M\\CM_{NaOH\left(dư\right)}=\frac{0,2}{0,5}=0,4M\end{matrix}\right.\)

Đáp án C
![]() = 0,8 mol
= 0,8 mol
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
0,8 → ![]() = 0,72 (mol)
= 0,72 (mol)
Vkhí = 0,72.22,4 = 16,128 (lit)
nNaOH = 2 (mol)
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,72 2 → 0,72 0,72 (mol)
do NaOH dư, tính theo Cl2
Dung dịch sau phản ứng: nNaCl = nNaClO = 0,72 (mol)
nNaOH dư = 0,56 (mol)
CNaCl = CNaClO = 1,44M, CNaOH = 1,12M

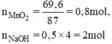
a) Phương trình hóa học của phản ứng:
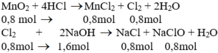
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 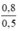 = 1,6 mol/ lit
= 1,6 mol/ lit
CM (NaOH)dư = 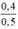 = 0,8 mol/ lit
= 0,8 mol/ lit

\(n_{MnO_2} = \dfrac{4,35}{87} = 0,05(mol)\)
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
0,05..................................0,05..................(mol)
\(n_{NaOH} = 0,3.0,1 = 0,03(mol)\)
2NaOH + Cl2 → NaCl + NaClO + H2O
0,03........0,05.....0,015.......0,015....................(mol)
Vậy :
\(C_{M_{NaCl}} = C_{M_{NaClO}} = \dfrac{0,015}{0,3} = 0,05M\)

nMnO2=\(\frac{17,4}{87}\)= 0,2 mol
MnO2+ 4HCl \(\rightarrow\)MnCl2+ Cl2+ 2H2O
\(\rightarrow\) nCl2= nMnO2= 0,2 mol
nNaOH= \(\frac{\text{ 145,8.20%}}{40}\)= 0,729 mol
Cl2+ 2NaOH\(\rightarrow\) NaCl+ NaClO+ H2O
Spu, NaOH dư 0,729-0,4= 0,329 mol; thu đc 0,2 mol NaCl; 0,2 mol NaClO
m dd spu= 0.2.71+ 145,8= 160g
C%NaOH dư= \(\frac{\text{ 0,329.40.100}}{160}\)= 8,225%
C%NaCl= \(\frac{\text{0,2.58,5.100}}{160}\)= 7,3125%
C%NaClO= \(\frac{\text{0,2.74,5.100}}{160}\)= 9,3125%

Câu 1:
2Al+ 6HCl---->2AlCl3+3H2
x-----3x----------------x----1,5x
Zn+2HCl----->ZnCl2+H2
y------2y------------y-----y
n HCl=0,4.2=0,8(mol)
Theo bài ta có hpt
\(\left\{{}\begin{matrix}27x+65y=11,9\\3x+2y=0,8\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
m AlCl3=0,2.133,5=26,7(g)
m ZnCl2=0,1.136=13,6(g)
b) Theo pthh
n H2=1/2n HCl=0,4(mol)
V H2=0,4.22,4=8,96(l)
c) m muối=26,7+13,6=40,3(g)
2)
a) MnO2+4HCl---->Cl2+2H2O+MnCl2
Cl2+ 2NaOH---->H2O+NaCl+NaClO
b)
nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng mk ghi lại cho dễ nhìn nha
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = = CM(NaClO) =\(\frac{0,8}{0,5}\)= 1,6 mol/l
CM(NaOH)dư = = 0,8 mol/l
3) 
Chúc bạn học tốt
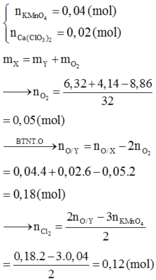

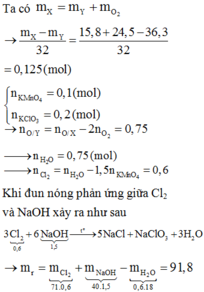
Số mol MnO2 = 3,48 : 87 = 0,04 mol
Số mol NaOH = 0,1.0,8 = 0,08 mol
Ptpư: MnO2 + 4HCl ---> MnCl2 + Cl2 + 2H2O
Cl2 + 2NaOH---> NaCl + NaClO + H2O
Theo ptpư: mol NaOH = 2mol Cl2 ---> phản ứng vừa đủ
mol NaCl = mol NaClO = mol Cl2 = 0,04 mol
--->CM(NaCl) = CM(NaClO) = 0,04 : 0,8 = 0,05(M)