cho V lit dd NaOH 2M vào dd chứa 0,1 mol Al2(SO4)3 và 0,1 mol H2SO4 đến khi phản ứng hoàn toàn thu đc 7,8 g kết tủa . Giá trị lớn nhất của V để thu đc lượng kết tủa trên là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khi cho NaOH vào, theo thứ tự sẽ xảy ra phản ứng với H2SO4. Bao giờ trung hoà hết axit mới phản ứng tiếp với Al2(SO4)3.
2 NaOH + H2SO4 -----> Na2SO4 + 2 H2O (1)
Al2(SO4)3 + 6 NaOH -----> 2 Al(OH)3 + 2 Na2SO4 (2)
Al(OH)3 + NaOH -----> NaAlO2 + 2 H2O (3)
Đầu tiên muốn tạo ra kết tủa thì ít nhất phải trung hoà hết axit đã. Từ (1) ta suy ra số mol NaOH để trung hoà hết H2SO4 = 2 x 0,2 = 0,4 (mol).
Kết tủa là Al(OH)3, ứng với số mol là:
11,7 : 78 = 0,15 (mol).
Đến đây ta chia làm hai trường hợp:
- Trường hợp 1 là chỉ xảy ra phản ứng (2) thôi (vì thiếu NaOH).
Từ (2) ta suy ra số mol NaOH cần dùng là 0,15 x 3 = 0,45 (mol).
Giá trị nhỏ nhất của V là (0,45 + 0,4) : 2 = 0,425 (lít).
- Trường hợp 2 là NaOH sau khi đã kết tủa toàn bộ chỗ Al2(SO4)3 rồi vẫn còn dư, nên hoà tan mất một phần kết tủa.
Từ (2) suy ra lượng NaOH cần để kết tủa hết muối nhôm là 0,1 x 6 = 0,6 (mol).
Cũng từ (2) suy ra số mol kết tủa là 0,1 x 2 = 0,2 (mol).
Có 0,2 mol kết tủa mà kết thúc chỉ còn lại 0,15 mol, suy ra NaOH hoà tan mất 0,2 - 0,15 = 0,05 (mol)
Vậy giá trị lớn nhất của V là: (0,4 + 0,6 + 0,05) : 2 = 0,525 (mol).
Nguồn

Đáp án A.
nAl(OH)3= 7 , 8 78 = 0 , 1
2NaOH + H2SO4 à Na2SO4 + 2H2O (1)
0,2 ß 0,1
Để NaOH phản ứng nhiều nhất thu được 0,1 mol kết tủa Al(OH)3 thì Al2(SO4)3 phải phản ứng hết tạo kết tủa tối đa, sau đó kết tủa tan một phần sao cho lượng kết tủa cuối cùng thu được bằng 0,1 mol.
6NaOH + Al2(SO4)3 à 3Na2SO4 + 2Al(OH)3 (2)
0,6 ß 0,1 à 0,2
NaOH + Al(OH)3 à NaAlO2 + 2H2O (3)
0,1 ß 0,1
Từ (1), (2) và (3) ta có:
nNaOH pư = 0,6 + 0,1 + 0,2 = 0,9 mol
è → Vdd NaOH = 0,9 : 2 = 0,45 M

Đáp án D
V có giá trị lớn nhất vậy có các phương trình

Vậy nNaOH = 0,9 ⇒ V = 0,45

Ta có n Al3+ = 0,2 mol ; n H+ = 0,2 mol
Để NaOH dùng là lớn nhất khi xảy ra trường hợp tạo kết tủa,sau đó kết tủa tan
=> n NaOH = n H+ + 4nAl3+ - n Kết tủa = 0,9 mol
=> V = 0,9/2 = 0,45
=>B

Đáp án A
Các phản ứng: Do cần lượng NaOH lớn nhất nên sẽ tạo ra cả Al(OH)3 ↓ và [A1(OH)4]-
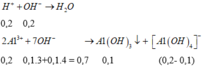
VNaOH max = (0,2+ 0,7)/2 = 0,45.
Cách bấm nhanh: V = (0,1.2+7,8:78.3+(0,1.2-7,8:78).4):2 = 0,45
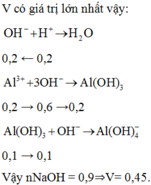
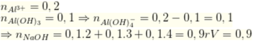



Ta có: \(n_{Al\left(OH\right)_3}=\dfrac{7,8}{78}=0,1\left(mol\right)\)
PTHH: \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2______0,1 (mol)
\(6NaOH+Al_2\left(SO_4\right)_3\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\downarrow\)
0,3________0,05___________________0,1 (mol)
Ta có: \(n_{NaOH}=0,5\left(mol\right)\) \(\Rightarrow V_{ddNaOH}=\dfrac{0,5}{2}=0,25\left(l\right)\)
đúng kiểu chồng tui