Tính khối lượng P để điều chế 21,3g P2O5 biết hiệu suất phản ứng bằng 75%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Số mol của đi photpho pentaoxit
nP2O5 = \(\dfrac{m_{P2O5}}{M_{P2O5}}=\dfrac{21,3}{142}=0,15\left(mol\right)\)
Pt : 4P + 5O2 → 2P2O5\(|\)
4 5 2
0,3 0,15
Số mol của photpho
nP = \(\dfrac{0,15.4}{2}=0,3\left(mol\right)\)
Khối lượng của photpho
mP = nP . MP
= 0,3 . 31
= 9,3 (g)
Khối lượng của photpho cần dùng
mtt = \(\dfrac{m_{lt}.100}{H}=\dfrac{9,3.100}{75}=12,4\) (g)
Chúc bạn học tốt

PT: \(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
Ta có: \(n_{Cl_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{KMnO_4\left(LT\right)}=\dfrac{2}{5}n_{Cl_2}=0,2\left(mol\right)\\n_{HCl\left(LT\right)}=\dfrac{16}{5}n_{Cl_2}=1,6\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{KMnO_4\left(LT\right)}=0,2.158=31,6\left(g\right)\\V_{ddHCl\left(LT\right)}=\dfrac{1,6}{2}=0,8\left(l\right)\end{matrix}\right.\)
Mà: H% = 75%
\(\Rightarrow\left\{{}\begin{matrix}m_{KMnO_4\left(TT\right)}=\dfrac{31,6}{75\%}\approx42,13\left(g\right)\\V_{ddHCl\left(TT\right)}=\dfrac{0,8}{75\%}\approx1,067\left(l\right)\end{matrix}\right.\)
Bạn tham khảo nhé!

\(PTHH:2Al_2O_3\rightarrow4Al+3O_2\)
Cứ \(204\)tấn\(Al_2O_3\)tham gia pứ thì thu được \(108\) tấn \(Al\)
\(\Rightarrow\)Để thu được \(5,4\) tấn \(Al\) cần \(10,2\)tấn \(Al_2O_3\)
Vì: \(H=75\%\Rightarrow m_{Al_2O_3}=\frac{10,2.100}{75}=13,6\)(Tấn)
Mà quặng chỉ chứa\(80\%Al_2O_3\)
\(\Rightarrow\) Khối lượng quặng để điều chế\(5,4\)tấn \(Al\) là:
\(m_{quặng}=\frac{13,6.100}{80}=17\)(Tấn)
Vậy ......

nO2 (TT) = 11,2/22,4 = 0,5 (mol)
nO2 (LT) = 0,5/80% = 0,625 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,625 . 2 = 1,25 (mol)
mKMnO4 = 1,25 . 158 = 197,5 (g)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{11,2}{22,4}=0,5mol\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MMnO_4+MnO_2+O_2\)
1 0,5 ( mol )
\(n_{KMnO_4}=\dfrac{1}{80\%}=1,25mol\)
\(m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=1,25.158=197,5g\)

\(n_{O_2} = \dfrac{5,6}{22,4} = 0,25(mol)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3\ pư} = \dfrac{2}{3}n_{O_2} = \dfrac{1}{6}(mol)\\ n_{KClO_3\ đã\ dùng} = \dfrac{ \dfrac{1}{6}}{85\%} = \dfrac{10}{51}(mol)\\ m_{KClO_3} = \dfrac{10}{51}.122,5 = \dfrac{1225}{51} = 24,02(gam)\)
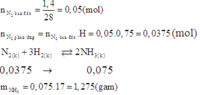



Phương trình hóa học phản ứng
4P + 5O2 ---> 2P2O5
4 : 5 : 2 (1)
Ta có : \(n_{P_2O_5}=\frac{m}{M}=\frac{21,3}{142}=0,15\left(mol\right)\) (2)
Từ (1) và (2) => nP = 0,3 (mol)
\(\Rightarrow m_P=m.M=0,3.31=9,3\left(mol\right)\)
Ta có \(\frac{m_{\text{phương trình}}}{m_{\text{thực tế}}}=75\%\Rightarrow\frac{9,3}{m_{\text{thực tế}}}=\frac{3}{4}\Rightarrow m_{\text{thực tế}}=12,4g\)
Vậy khối lượng P = 12,4 (g)