Nung 25,28 gam hỗn hợp FeCO3 và FexOy trong O2 dư tới phản ứng hoàn toàn, thu được khí A và 22,4 gam Fe2O3 duy nhất. Cho khí A hấp thụ hoàn toàn vào 400ml dung dịch Ba(OH)2 0,15M thu được 7,88gam kết tủa.
1) Viết các phương trình phản ứng xẩy ra
2) Tìm công thức phân tử của FexOy.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Số mol CO2 = 0.04 -> Số mol CO3- = 0.04
=> Số mol Fe trong FeCO3=0.04
Số mol Fe2O3=0.14
=> Số mol Fe3+ = 0.28 => Số mol Fe trong FexOy = 0.24 => Số mol FexOy = 0.24/x
Từ khối lượng hỗn hợp X ta có PT: 23.2 - 0.04*116 = (56x + 16y)*0.24/x Từ đó => x/y = 3/4Thể tích
HCL = n/CM = (0.04*2 + 0.08*8)/2 = 0.36l = 360 ml

Ta có :
4FeCO3 + 02---> 2Fe2O3 + 4CO2 (1)
4FexOy + (3x-2y) O2----> 2xFe2O3(2)
CO2+ Ba(OH)2 ---> BaCO3 + H2O (3)
BaCO3 +CO2 +H2O ---> Ba(HCO3)2 (4)
n BaCO3= 7,88: 197 = 0,04
n Ba(OH) 2 = 0,06
* TH1 : CO2 dư --> có phản ứng 4 , khi đó :
nFeCO3 = nCO2 ở (1) = nCO2 ở (3) + số mol CO2 ở (4)= 0,08
Do đó , m FeCO3 = 9,28g
khối lượng O2 tham gia P/u 1 và 2 là:
25,28 - ( 22,4 + 0,08 . 44)= 0,64 g
m O2 tham gia p/u 1 là : 0,08:4.32=0,64g ---> FexOy là Fe2O3
* TH2 : Nếu O2 thiếu --> hok có p/u 4
---> tính toán ----> trường hợp này loại

Các oxit sắt, nung ngoài không khí đến khối lượng không đổi luôn tạo thành Fe2O3 16 gam oxit sắt duy nhất là Fe2O3.
Cách 1: Phương pháp đại số
Đặt số mol các chất trong 18,56 gam A F e C O 3 : n ; F e x O y : m
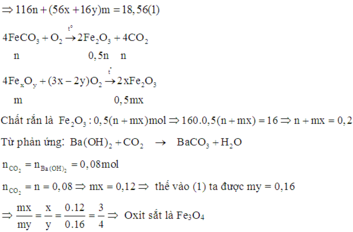
Cách 2: Phương pháp bảo toàn
Đặt số mol các chất trong 18,56 gam A F e C O 3 : n ; F e x O y : m
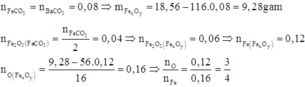
Cách 3: Bảo toàn nguyên tử C và O:
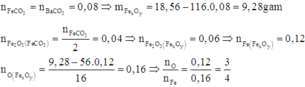
⇒ Oxit của sắt là Fe3O4
Cách 4: Bảo toàn nguyên tử và khối lượng:
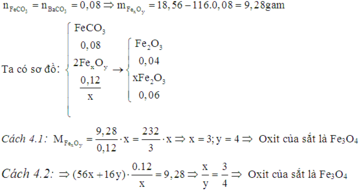
Đáp án B.
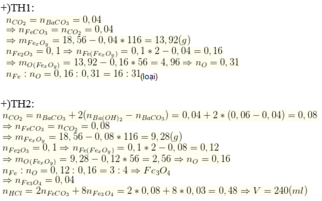
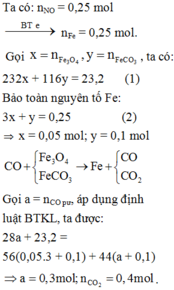
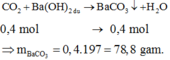


bạn xem ở link này nè có lời giải khá chi tiết đấy: http://hoctap.dvtienich.com/questions/question/nung-2528-gam-hon-hop-feco3-va-fexoy-trong-oxi-du-toi-phan-ung-hoan-toan/