Câu 21: Phân hủy 0,3 mol KClO3 thể tích khí O2 thu được ở đktc là: …………
Câu 23: Hòa tan 11,2 gam KOH vào nước để được 500ml dung dịch. Nồng độ mol của dung dịch thu được là: ……..
Câu 27: Hòa tan hết 5,44g hỗn hợp gồm Ca và CaO vào trong nước dư. Sau phản ứng thu được 1,972 lít khí H2 (đktc). Khối lượng chất tan có trong dung dịch là: ……..
Câu 29: Số gam chất tan CuSO4 có trong 70 gam dung dịch 20% là: ………

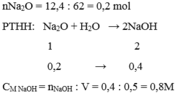
Câu 21 :
Pt : 2KClO3 → 2KCl + 3O2\(|\)
2 2 3
0,3 0,45
Số mol của khí oxit
nO2 = \(\dfrac{0,3.3}{2}=0,45\left(mol\right)\)
Thể tích của khí oxi ở dktc
VO2 = nO2 . 22,4
= 0,45 . 22,4
= 10,08 (g)
Câu 23 :
Số mol của kali hidroxit
nKOH = \(\dfrac{m_{KOH}}{M_{KOH}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Pt : 500ml = 0,5l
Nồng độ mol của dung dịch thu được
CM = \(\dfrac{n}{V}=\dfrac{0,2}{0,5}=0,4\left(M\right)\)
Chúc bạn học tốt
Câu 27 :
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{1,972}{22,4}=0,08\left(mol\right)\)
Pt : Ca + H2O → Ca(OH)2 + H2\(|\)
1 1 1 1
0,08 0,08 0,08
CaO + H2O → Ca(OH)2\(|\)
1 1 1
0,04 0,04
Số mol của canxi
nCa = \(\dfrac{0,08.1}{1}=0,08\left(mol\right)\)
Khối lượng của canxi
mCa= nCa . MCa
= 0,08 . 40
= 3,2 (g)
Khối lượng của canxi oxit
mCaO = 5,44 - 3,2
= 2,24 (g)
Số mol của canxi oxit
nCaO = \(\dfrac{m_{CaO}}{M_{CaO}}=\dfrac{2,24}{56}=0,04\left(mol\right)\)
nCaO= 0,04 (mol) → nCa(OH)2 = 0,04 (mol)
Số mol tổng của canxi hidroxit
nCa(OH)2 = 0,08 + 0 ,04 = 0,12 (mol)
Khối lượng của canxi hidroxit
mCa(OH)2= nCa(OH)2. MCa(OH)2
= 0,12 . 74
= 8,88 (g)
Câu 29 :
Khối lượng của đồng (II) sunfat
C0/0CuSO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{20.70}{100}=14\left(g\right)\)
Chúc bạn học tốt