trộn 100g dung dịch chứa muối sunfat của kim loại kiềm nồng độ 13,2% với 100g dung dịch NaHCO3 4,2%..sau phản ứng thu được dung dịch A có khối lượng là m gam (m<200g)..cho 100g dung dịch BaCl2 20,8% vào dung dịch A ,, sau khi phản ứng xong vẫn thấy dư dung dịch muối sunfat .. lại thêm 20g dung dịch BaCl2 20,8% nữa thì lại dư BaCl2 và lúc này được dung dịch D..hãy xác định công thức hóa học muối sunfat của kim loại kiềm ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
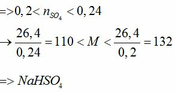
b)
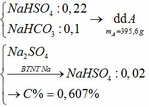
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O


BTKL: mD + mNaHCO3 = mCO2 + mE
mD + 179,88 = 44.0,2 + 492 => mD = 320,92
BTKL: mMg + mddHCl = mH2 + mD
=> 24 . 0,4 + mddHCl = 2 . 0,4 + 320,92 => mddHCl = 312,12
=> C%HCl = 11,69%

a)
$MCl_2 + H_2SO_4 \to MSO_4 + 2HCl$
$n_{MCl_2}= n_{MSO_4}$
$\Rightarrow \dfrac{31,2}{M + 71} = \dfrac{34,95}{M + 96}$
$\Rightarrow M = 137(Bari)$
b)
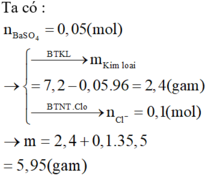
$n_{H_2SO_4} = n_{BaSO_4} = \dfrac{34,95}{233} = 0,15(mol)$
$m_{dd\ H_2SO_4} = \dfrac{0,15.98}{20\%} = 73,5(gam)$
c)
$n_{HCl} = 2n_{BaSO_4} = 0,3(mol)$
$m_{dd}= 31,2 + 73,5 - 34,95 = 69,75(gam)$
$C\%_{HCl} = \dfrac{0,3.36,5}{69,75}.100\% = 15,7\%$

Đáp án A
nH3PO4 = 2nP2O5 = 2.36,92/142 = 0,52 mol
M + H2O → MOH + ½ H2 ↑
Phản ứng xảy ra theo thứ tự:
H3 PO4 + MOH → MH2PO4 + H2O
MH2PO4 + MOH → M2HPO4 + H2O
M2HPO4 + MOH → M3PO4 + H2O
Xét hai trường hợp:
TH1: Hai muối là M2HPO4 và MH2PO4 ⇒n MH2PO4 = nM2HPO4 = 0,26
nM= nMH2PO4 + 2n M2HPO4 = 0,78 mol ⇒ M = 17,94/0,78 = 23(Na)
TH2: Hai muối là: M2HPO4 và M3PO4 ⇒ n M2HPO4 = n M3PO4 = 0,26
nM = 2n M2HPO4 + 3nM3PO4 = 1,3 mol ⇒ M = 17,94/1,3 = 13,8(loại)

. Do trộn 100g với 100g mà lượng dung dịch thu được < 200g thì muối sunfat kim loại là muối axit.( do sự thất thoát khí )
pt : 2MHSO4 + 2NaHCO3 = M2SO4 + Na2SO4 + 2CO2 + 2H2O
Sự thoát khí CO2 làm giảm khối lượng ( số mol CO2 = số mol NaHCO3 0,05mol)
gọi số mol của MHSO4 là x ta có:
(M + 97) x = 13,2 => x = 13,2/ (M + 97)
Theo phương trình sự tạo kết tủa với BaCl2 là muối sunfat:
MNaSO4 + BaCl2 = BaSO4 + MCl + NaCl
=> Với 0,1 < x < 0,1 + 0,02 thì 13< M < 35 thoả mãn Na = 23 Vậy công thức sunfat là NaHSO4