khử 8g oxit của 1 kim loại cần 3,36l CO(đktc) mặt khác để hòa tan vừa hết lượng kim loiaj vừa thu được cần dùng 200ml dd HCl 1M. Xác định công thức của oxit ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi CTHH của oxit kim loại ban đầu là A2Oa
Gọi b là hóa trị thấp nhất của kim loại A
(a,b thuộc N sao, có thể a=b)
Số mol CO : 3,36:22,4=0,15(mol)
A2Oa + aCO -> 2A + aCO2
0,15/a 0,15 0,3/a 0,15 (mol)
Số mol HCl : 0,2x1=0,2(mol)
2A + 2b HCl -> AClb + bH2
0,2/b 0,2 0,1/b 0,1 (mol)
Ta có : 0,3/a = 0,2/b
=> a/b =3/2 =>a=3, b=2
Vậy A có 2 hóa trị II và III
Ta có :mA2Oa = 8 (g)
=> (MA x2+16a) x 0,15/a = 8 (g)
=> (MA x0,3)/a+ 2,4 =8
=> MA x0,1= 5,6
=> MA =5,6:0,1=56(g)
Vậy Kim loại cần tìm là Fe
CTHH của oxit cần tìm là Fe2O3.
Mk lâu r k hok hóa, nếu sai mog bạn thông cảm =))

gọi R là kim ***** ban đầu \(\rightarrow\) CTOXKL là RxOy (y là hóa trị của R )
RxOy+yCO\(\rightarrow\) xR+2CO2
R+2yHCl\(\rightarrow\) RCly+yH2

\(Đặt:CT:M_xO_y\)
\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(n_{Cl_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(M_xO_y+yH_2\underrightarrow{t^o}xM+yH_2O\)
\(n_{O\left(oxit\right)}=n_{H_2O}=n_{H_2}=0.15\left(mol\right)\)
\(\Rightarrow m_M=m_{oxit}-m_O=12-0.15\cdot16=9.6\left(g\right)\)
\(2M+nCl_2\underrightarrow{t^o}2MCl_n\)
\(\dfrac{0.3}{n}....0.15\)
\(M_M=\dfrac{9.6}{\dfrac{0.3}{n}}=32n\)
\(BL:\) \(n=2\Rightarrow M=64\)
\(CT:CuO\)

Bài 1
FexOy+ yH2 -----t---> xFe+ yH2O
Fe+ H2SO4-----> FeSO4+ H2
nH2=0.15 mol
mH2SO4=100*98%=98 g
Gọi a là số g nước tạo ra đc hấp thụ vào H2SO4 trên
Ta có:\(\dfrac{98}{100+a}=98\%-3.405\%=94.595\%\)
=>a≃3.6 g=>nH2O=0.2 mol
Theo PTHH (2) nFe=nH2=0.15 mol
Do vậy: \(\dfrac{n_{Fe}}{n_{H2O}}=\dfrac{x}{y}=\dfrac{0.15}{0.2}=\dfrac{3}{4}\)
=>x=3; y=4
=>CTHH: Fe3O4

n CO = 6,72/22,4 = 0,3(mol)
n H2 = 2,24/22,4 = 0,1(mol)
B gồm : CO(x mol) ; CO2(y mol)
M B = 18.2 = 36
x + y = 0,3
28x + 44y = 36(x + y)
=> x = y = 0,15
$CO + O_{oxit} \to CO_2$
n O(oxit) = n CO2 = 0,15(mol)
=> m M = 8 - 0,15.16 = 5,6(gam)
n là hóa trị của M
$2M + 2HCl \to 2MCl_n + nH_2$
n M = 2/n . nH2 = 0,2/n (mol)
=> 0,2/n . M = 5,6
=> M = 28n
Với n = 2 thì M = 56(Fe)
n Fe = 5,6/56 = 0,1(mol)
n Fe / n O = 0,1/0,15 = 2/3 . Vậy oxit là Fe2O3

nH2SO4 = \(\frac{300.9,8\%}{98}\) = 0,3 (mol)
M2O3 + 3H2SO4 \(\rightarrow\) M2(SO4)3 + 3H2O
0,1 \(\leftarrow\) 0,3 ---------> 0,1 (mol)
MM2O3 = \(\frac{10,2}{0,1}\)= 102 (g/mol)
\(\Rightarrow\) M = \(\frac{102-3.16}{2}\) = 27 (Al)
=> Al2O3
C%(muối)= \(\frac{0,1.342}{10,2+300}\) . 100% = 11,03 %

Đáp án A
Oxit chưa biết của kim loại nào → Gọi MxOy
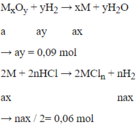
Mà : 56ax + 16ay = 4,8
→ ax = 0,06
→ x : y = ax : ay = 0,06 : 0,09 = 2 : 3 => M2O3
→ n = 0,12 : 0,06 = 2 => M hóa trị II
→ Chỉ có Fe thỏa mãn vì nó có hai hóa trị
Lưu ý: Bài toán này dễ nhầm lẫn nếu không để ý sự thay đổi hóa trị ở 2 phương trình.
Gọi kim loại là M ta có
PTHH: MxOy + y H2 xM + yH2O
8(g) 3,36 lít
8:(Mx+16y) 0,15 (0,15x):y 0,15 (mol)
PTHH2: M + 2xHCl -> MClx + xH2
(0,15x):y 0,1 mol
Ta thấy nM=(0,15.x):(x.y)=0.15:y mol và 0.15:y=8:(Mx+16y)
Rút ra x/y=2/3 và M=56
Vậy đó là Fe2O3
bạn ơi là CO chứ đâu phải là H2 đâu. Bạn nhầm rồi.