Hoà tan hoàn toàn 2,4g kim loại A hóa trị II vào trong 100ml dung dịch HCl 1,5M. Sau phản ứng vẫn thấy còn một phần A chưa tan hết. Cũng 2,4g A trên nếu tác dụng với 125ml dung dịch HCl 2M thì thấy còn dư axit sau phản ứng. Xác đinh kim loại R.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nHCl = 0,35 . 1 = 0,35 (mol)
\(X+2HCl\rightarrow XCl_2+H_2\)
0,175 0,35 0,175 0,175 (mol)
nHCl (pứ 2 ) = 0,2 . 2 = 0,4 (mol)
\(X+2HCl\rightarrow XCl_2+H_2\)
0,2 0,4
\(nX=0,175+0,2=0,375\left(mol\right)\)
=> \(MX=\dfrac{11,7}{0,375}=\) 31,2 .-. k ra là s

- Khi cho 2,4g X vào 200ml ddHCl 0,75M
nHCl = 0,2.0,75 = 0,15 (mol)
....\(X+2HCl\rightarrow XCl_2+H_2\)
0,075.....0,15...............................(mol)
do X còn dư nên \(\dfrac{2,4}{X}>0,075\Leftrightarrow X< 32\) (1)
- Khi cho 2,4g X vào 250ml ddHCl 1M
nHCl = 0,25.1 = 0,25 (mol)
...\(X+2HCl\rightarrow XCl_2+H_2\)
\(\dfrac{2,4}{X}\)......\(\dfrac{4,8}{X}\)..............................(mol)
axit còn dư \(\Rightarrow\dfrac{4,8}{X}< 0,25\Leftrightarrow X>19,2\) (2)
Từ (1) và (2) \(\Rightarrow\) 19,2 < X < 32 mà X là kim loại hóa trị II \(\Rightarrow X=24\)
Vậy kim loại X là Mg

\(n_{H_2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH
\(X+2HCl\rightarrow XCl_2+H_2\)
0,1mol 0,2mol 0,1mol 0,1 mol
\(M_X=\frac{2,4}{0,1}=24\left(g\right)\)
Vậy kim loại X thuộc nguyên tố Mg
nH2=2,24/22,4=0,1 mol
X +2HCl =>XCl2 +H2
0,1 mol<= 0,1 mol<=0,1 mol
a) Từ PTHH=>nX=0,1 mol
MÀ mX=2,4(g)=>MX=24=>X là Mg
b) nXCl2=nMgCl2=0,1 mol=>mMgCl2=0,1.95=9,5g
c) đề bài thiếu dữ kiện em

nH2=0,1 mol
Gọi R là khối lượng mol trung bình của Fe và kl hoá trị II
R + 2HCl ----> RCl2 + H2
-> R = 4/0,1 =40
-> M(kl)< 40 < 56(Fe) (1)
M + 2HCl -----> RCl + H2
0,5 0,5
nHCl=0,5mol
Theo đề bài: 2,4g KL hoá trị II không dùng hết 0,5 mol HCl
-> 2,4/M< 0,25
->M< 4,9 (2)
Từ (1) và (2) ta có:
9,6< M <40
Duwaj vào bảng THHH -> M là Mg (24)
Thấy đúng thì follow nhé fb : https://www.facebook.com/themlannua.haytinanh.7 ![]()
Mình cũng mới gặp bài này mới đây thôi,phương pháp này có thể sử dụng Bảng THHH có gì không hiểu lên hệ facebook mình : https://www.facebook.com/themlannua.haytinanh.7

\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(2A+2nHCl\rightarrow2ACl_n+nH_2\)
\(\dfrac{0.2}{n}.......................0.1\)
\(M_A=\dfrac{2.4}{\dfrac{0.2}{n}}=12n\left(\dfrac{g}{mol}\right)\)
\(BL:n=2\Rightarrow M=24\)
\(A:Mg\)
\(m_{MgCl_2}=0.1\cdot95=9.5\left(g\right)\)
\(m_{ddHCl}=\dfrac{0.2\cdot36.5}{7.3\%}=100\left(g\right)\)
\(m_{dd}=2.4+100-0.1\cdot2=102.2\left(g\right)\)
\(C\%_{MgCl_2}=\dfrac{9.5}{102.2}\cdot100\%=9.3\%\)

Gọi n M 2 O = a thì nMOH = 2a, mỗi phần có nMOH = a
Khi nHCl = 0,095 thì dung dịch sau phản ứng làm quỳ tím hóa xanh nên MOH dư => a > 0,095
Khi nHCl = 0,11 thì dung dịch sau phản ứng làm quỳ tím hóa đỏ nên HCl dư => a < 0,11
Có 0,095 < a < 0,11
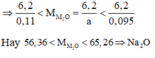
Đáp án B












fe
ra Mg bạn ơi và bạn giải chi tiêt cho mình hỉu đi