Nhiệt phân 66,2g Chì(II) nitrat tạo ra 55,4g chất rắn. Tính % Chi(II) nitrat bị phân hủy
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2Fe(OH)3→Fe2O3+3H2O
2KNO3→2KNO2+O2
2Cu(NO3)2→2CuO+4NO2+O2
2AgNO3→2Ag+2NO2+O2
a)Sắt(III)hidroxit bị nhiệt phân hủy tạo thành Sắt (III)oxit + nước
2 Fe(OH)3 → Fe2O3 + 3 H2O [Nhớ thêm điều kiện to]
b) Kali nitrat bị nhiệt phân hủy thành kali nitrit + khí oxi
2 KNO3 → 2 KNO2 + O2 [Nhớ thêm điều kiện to]
c) Đồng(II) nitrat bị nhiệt phân hủy thành Đồng(II)oxit + khí nito dioxit + khí oxi
2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2 [Nhớ thêm điều kiện to]
d) Bạc nitrat bị nhiệt phân hủy thành Bạc + nitodioxit + khí oxi
2 AgNO3 → 2 Ag + 2 NO2 + O2 [Nhớ thêm điều kiện to]

\(n_{Cu\left(NO_3\right)_2}=\dfrac{15,04}{188}=0,08\left(mol\right)\)
Gọi số mol Cu(NO3)2 pư là a
PTHH: 2Cu(NO3)2 --to--> 2CuO + 4NO2 + O2
a---------------->a------->2a
=> 188(0,08-a) + 80a = 8,56
=> a = 0,06
=> \(\left\{{}\begin{matrix}m_{Cu\left(NO_3\right)_2}=\left(0,08-0,06\right).188=3,76\left(g\right)\\m_{CuO}=0,06.80=4,8\left(g\right)\end{matrix}\right.\)
=> mCu(NO3)2 bị phân hủy = 0,06.188 = 11,28(g)
Có lẽ bài này nhường chỗ cho idol của mình là Quang Nhân :))

Vì hỗn hợp rắn sau phản ứng có phản ứng với H2 nên hỗn hợp này có chứa oxit kim loại. Có thể coi quá trình khử oxit kim loại bởi H2 diễn ra đơn giản như sau:

Vì trong sản phẩm rắn có oxit kim loại và nên cả hai muối trong hỗn hợp khi nhiệt phân đều tạo ra oxit kim loại tương ứng (hai kim loại hóa trị II không đổi).
Gọi công thức chung của hai muối là M ( N O 3 ) 2 .
M ( N O 3 ) 2 → t 0 M O + 2 N O 2 + 1 2 O 2
Do đó n M ( N O 3 ) 2 = n M O = 2 n O 2 = 0 , 2
Mà khi cho hỗn hợp oxit này phản ứng với H2 dư thì chỉ có 0,1 mol H2 phản ứng. Nên trong hỗn hợp oxit thu được chứa 0,1 mol oxit của kim loại đứng sau Al (bị khử bởi H2) và 0,1 mol oxit của kim loại đứng trước Al (không bị khử bởi H2) trong dãy hoạt động hóa học của kim loại.
Mà trong các kim loại đứng trước Al trong dãy hoạt động hóa học của kim loại thì kim loại có hóa trị II không đổi và khi nhiệt phân muối nitrat của nó thu được oxit kim loại chỉ có Ba và Mg.
Nên trong hỗn hợp hai muối chứa Ba(NO3)2 hoặc Mg(NO3)2.
Vì số mol của mỗi oxit kim loại trong hỗn hợp đều là 0,1 nên khối lượng mol trung bình M là giá trị trung bình cộng khối lượng mol của hai kim loại.
Có M M ( N O 3 ) 2 = m n = 45 0 , 2 = 225 ⇒ M = 101
Gọi muối còn lại trong hỗn hợp ban đầu là R(NO3)2.
+) Nếu hỗn hợp muối có Mg(NO3)2 thì: 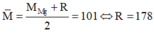 (loại)
(loại)
+) Nếu trong hỗn hợp muối chứa Ba(NO3)2 thì ta có: 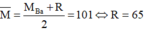
. Do đó hai kim loại cần tìm là Ba và Zn.
Đáp án A.

Đáp án D
Vì hỗn hợp rắn sau phản ứng nhiệt phân có phản ứng với H2 nên trong hỗn hợp đó có chứa oxit của kim loại có khả năng phản ứng với H2.
Có thể coi quá trình khử diễn ra đơn giản như sau:
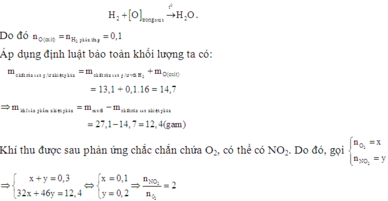

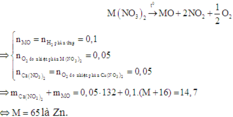
Vậy hai muối cần tìm là Ca(NO3)2 và Zn(NO3)2.
Nhận xét: Khi đến bước xác định được hỗn hợp có Ca(NO3)2 thì quan sát 4 đáp án, các bạn có thể kết luận được ngay đáp án đúng là D.

\(n_{Cu\left(NO_3\right)_2}=\dfrac{15.04}{188}=0.08\left(mol\right)\)
\(n_{O_2}=x\left(mol\right)\)
\(2Cu\left(NO_3\right)_2\underrightarrow{t^0}2CuO+4NO_2+O_2\)
\(2x......................4x......x\)
\(BTKL:\)
\(m_{NO_2}+m_{O_2}=15.04-8.56=6.48\left(g\right)\)
\(\Rightarrow4x\cdot46+32x=6.48\)
\(\Rightarrow x=0.03\)
\(\%Cu\left(NO_3\right)_{2\left(ph\right)}=\dfrac{0.03}{0.08}\cdot100\%=37.5\%\)
\(b.\)
\(\overline{M}=\dfrac{6.48}{0.12+0.03}=43.2\left(\dfrac{g}{mol}\right)\)
\(d_{\dfrac{hh}{H_2}}=\dfrac{43.2}{2}=21.6\)
\(c.\)
\(H\%=\dfrac{0.03}{0.08}\cdot100\%=37.5\%\)
\(\)

a) Ta có: nCu(NO3)2 =\(\frac{15,416}{188}=0,082\left(mol\right)\)
PTHH: 2Cu(NO3)2 =(nhiệt)=> 2CuO + 4NO2 + O2
Gọi số mol Cu(NO3)2 bị phân hủy là a (mol)
=> Số mol Cu(NO3)2 dư: nCu(NO3)2 (dư) = 0,082 - a (mol)
=> Khối lượng Cu(NO3)2 dư: mCu(NO3)2 (dư) = 188.(0,082 - a) (gam)
Mặt khác: Theo PTHH, nCuO = nCu(NO3)2 = a (mol)
=> Khối lượng CuO: mCuO = 80a (gam)
Theo đề ra, mA = mCu(NO3)2(dư) + mCuO = 8,3312 (gam)
\(\Leftrightarrow188\left(0,082-a\right)+80a=8,3312\)
\(\Leftrightarrow a=0,0656\left(mol\right)\)
=> %mCu(NO3)2 (bị phân hủy) = \(\frac{0,0656}{0,082}\times100\%=80\%\)
b. Gợi ý:
- Tính số mol của CuO. NO2 , O2 ( đã biết a = 0,0656 )
- Suy ra số mol O trong mỗi chất
- Tính số nguyên tử O
c. Gợi ý:
- Đã tính số mol NO2, O2 trên phần b
- Tính thể tích ở điều kiện tiêu chuẩn ( 20oC, 1 atm chính là đktc )
P/s: Có việc bận nên chỉ ghi gợi ý... ![]()

Đáp án B
Vì hỗn hợp rắn sau phản ứng có phản ứng với H2 nên trong hỗn hợp này có chứa oxit kim loại có khả năng phản ứng với H2.
Có thể coi quá trình oxit kim loại phản ứng với H2 diễn ra đơn giản như sau:
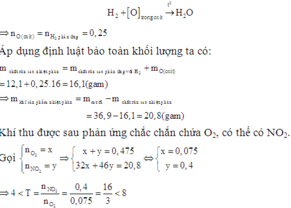
Mà hỗn hợp ban đầu là hai muối nitrat của hai kim loại hóa trị II (đề bài không đưa ra giả thiết hóa trị không đổi) nên để thu được tỉ lệ số mol giữa NO2 và O2 như trên thì hỗn hợp chứa một muối nitrat của kim loại có hóa trị II không đổi (khi nhiệt phân cho n N O 2 : n O 2 ≤ 4 ) và một muối nitrat kim loại nhiệt phân tạo thành oxit của kim loại có hóa trị của kim loại tăng từ II trong muối lên hóa trị III trong oxit (khi nhiệt phân cho n N O 2 : n O 2 = 8).Gọi công thức của hai muối trong hỗn hợp ban đầu là M(NO3)2 và R(NO3)2 trong đó kim loại M có hóa trị II không đổi.
Các trường hợp có thể xảy ra:
+) M(NO3)2 nhiệt phân tạo muối nitrit : ( n N O 2 : n O 2 = 0)
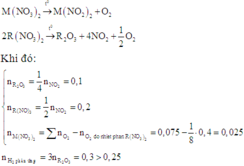
Do đó trường hợp này không thỏa mãn.
+) M(NO3)2 nhiệt phân tạo oxit kim loại tương ứng ( n N O 2 : n O 2 = 4)
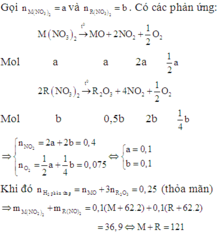
Mặt khác, với kiến thức THPT thì những kim loại nằm trong trường hợp nhiệt phân muối nitrat tạo oxit kim loại với hóa trị tăng từ II lên III thì ta biết Fe hoặc Cr.
Nên
* Nếu R là Fe thì M = 121 – 56 = 65 là Zn
* Nếu R là Cr thì M = 96 – 52 = 46 (loại)
+) M(NO3)2 nhiệt phân tạo kim loại tương ứng ( n N O 2 : n O 2 = 2)
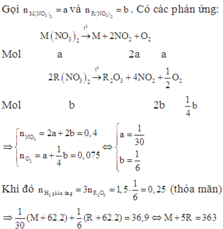
Tương tự như trường hợp 2, ta có:
* Nếu R là Fe thì M = 363– 56.5 = 83 (loại)
* Nếu R là Cr thì M = 363 – 52.5 = 103 (loại)
Vậy hai kim loại cần tìm là Zn và Fe.
PTPU: Pb(NO3)2 ---> PbO + 2NO2 + 1/2O2
gọi số mol NO2 là x => số mol O2 là x/4 và số mol Pb(NO3)2 = x/2
ta có 66,2 - 55,4 = 10,8 (khối lượng khí thoát ra NO2 và O2) = 46x + 8x
=> x = 0,2 => số mol Pb(NO3)2 = 0,1
Mà ban đầu số mol Pb(NO3)2 = 66,2/331 = 0,2
=> H = 50%