Cho 0,51 gam hỗn hợp A gồm Fe và Mg vào 100 ml dd CuSO4 . Sau khi các phản ứng xảy ra hoàn toàn, lọc thu được 0,69 gam rắn B và dd C. Thêm NaOH dư vào dd C, lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi được 0,45 gam chất rắn D.
a/ Tínhnồng độ mol CUSO4 b/ Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp Ac/ Tính thể tích SO2 bay ra khi hòa tan chất rắn B trong H2SO4 đặc nóng dưHãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Số mol Fe = 0,02 mol; số mol Cu = 0,03 mol; số mol H+ = 0,4 mol;
số mol NO3- = 0,08 mol
Các phản ứng xảy ra:
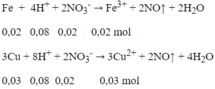
Sau 2 phản ứng trên, trong dung dịch X có 0,02 mol Fe3+; 0,03 mol Cu2+ và 0,24 mol H+ dư, ngoài ra còn có ion NO3- và SO42-. Tuy nhiên chỉ có 3 loai ion đầu là phản ứng với OH-.
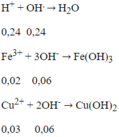
Tổng số mol OH- = 0,24 + 0,06 + 0,06 = 0,36 mol
→ V = 360ml

Đáp án A
Sơ đồ phản ứng :
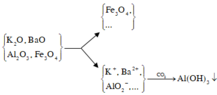
Chất rắn Y có Fe3O4 và có thể còn Al2O3 chưa phản ứng hết. Dung dịch X có có Ba2+, K+, AlO 2 - và có thể có OH - . Sục CO2 dư vào X chỉ thu được kết tủa là Al(OH)3.
Phương trình phản ứng :
![]()
Giả sử trong Y có OH - thì do CO2 có dư nên xảy ra phản ứng :
![]()
Do đó không thể có kết tủa BaCO3.

Chọn A
Chất rắn Y có Fe3O4 và có thể còn Al2O3 chưa phản ứng hết. Dung dịch X có có Ba2+, K+, A l O 2 - và có thể có O H - . Sục CO2 dư vào X chỉ thu được kết tủa là Al(OH)3.

Đáp án C
Phương trình phản ứng:
K2O + H2O → 2KOH
BaO + 2H2O → Ba(OH)2
Al2O3 + OH- → 2AlO2- + H2O
⇒Chất rắn Y: Fe3O4, dung dịch X chứa ion AlO2-
AlO2- + CO2 + H2O → Al(OH)3 + HCO3-

Đáp án C
Al2O3 + 2OH- + 3H2O → 2Al(OH)4-
Al(OH)4- + CO2 → Al(OH)3 + HCO3-

\(n_{SO_2}=\dfrac{1,008}{22,5}=0,045\left(mol\right)\)
\(n_{Fe_2\left(SO_4\right)_3}=\dfrac{18}{400}=0,045\left(mol\right)\)=> \(n_{Fe}=0,09\left(mol\right)\)
Quy đổi Y thành Fe (0,09_mol ) O (a_mol )
\(Fe\rightarrow Fe^{3+}+3e\) \(S^{+6}+2e\rightarrow S^{+4}\)
\(O+2e\rightarrow O^{2-}\)
Bảo toàn e : 0,09.3=0,045.2 + a.2
=> a=0,09
Ta có : \(m_Y=m_{Fe}+m_O=0,09.56+0,09.16=6,48\left(g\right)\)
Khí Z là CO2 và CO dư
\(n_{CaCO_3}=n_{CO_2}=0,04\left(mol\right)\)
Bản chất của phản ứng :
CO + O ------> CO2
=> \(n_{O\left(trongoxitpu\right)}=n_{CO_2}=0,04\left(mol\right)\)
=> \(m_X=m_Y+m_{O\left(trongoxitpu\right)}=6,48+0,04.16=7,12\left(g\right)\)

Bài 1: Gọi số mol Mg là x, số mol Fe pư là y. số mol Fe dư là z => số mol Cu tạo thành là x + y.
Chất rắn thu được cuối cùng là MgO x mol và Fe2O3 y/2 mol
=> 24x + 56y + 56z = 1,02
64x + 64y + 56z = 1,38.
40x + 80y = 0,9
=> x = y = z = 0,0075 mol.
Vậy, trong A có mMg = 0,0075. 24 = 0,18 g. mFe = 0,0075. 2 . 56 = 0,84g. và CM CuSO4 = 0,0075.2 : 0,2 = 0,075M
Bài 2 tương tự nhé.
24x + 56y + 56z = 12,88.
2x. 108 + 2y. 108 + 56z = 48,72.
40x + 80y = 14.
=> x = 0,07. y = 0,14. z = 0,06
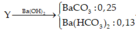
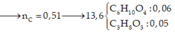
gọi x,y lần lượt là số mol của Fe, Mg:
Fe + CuSO4------> FeSO4 + Cu (1)
x x
Mg + CuSO4 -----> MgSO4 + Cu(2)
y y
a)nCu= 0.69/64=0.01 mol
theo gt, ta có hệ pt: 56x + 24y = 0.51
x + y = 0.01
giải hệ ,ta có x=0.008 , y=0.002
có ncuso4 =>C\(_M\) = (0.008+0.002)/0.1=1M(0.1 là do anh đổi ra lít nha em)
b) mFe=0.008*56=0.448g=> %Fe=0.448*100/0.51\(\approx\)87.84%
tương tự %Cu =12.16%
c) Cu + 2H2SO4 ---> 2H2O + SO2 + CuSO4
0.01 0.01
VSO2= 0.01*22.4=0.224 l
giai xong mệt quá zzzzzz....Chúc em học tốt !!!!!
cám ơn anh