Cho 6,72 lít h2 X (O2 và Cl2) có tỉ khối so với H2 là 22.5 tác dụng vừa đủ với h2 Y( Al và Mg) thu được 23,7g h2 clorua và oxit của hai kim loại. Tính % về khối lượng các chất có trong X và Y
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


*) Xét 6,72 lít hỗn hợp X. Gọi số mol O2 và Cl2 lần lượt là x, y mol.
nhh=0,3mol;
¯M=22,5.2=45
Khi đó ta có hpt:
x+y=0,3
¯M=32x+71y\x+y=45
→{x=0,2y=0,1mol
⇒%mO2=0,2.32\0,2.32+0,1.71.100%=47,4%;%mCl2=100−47,4=52,6%
*) Gọi số mol Al và Mg lần lượt là a, b mol →
số mol AlCl3và MgCl2 lần lượt là a, b mol →
Các quá trình cho và nhận e:
Al0→Al+3+3e; Mg0→Mg+2+2e
O2+4e→2O2−;Cl2+2e→2Cl−
Bảo toàn e: 3a+2b=0,2.4+0,1.2=1 (1)
Mà hỗn hợp clorua và oxit của hai kim loại có khối lượng 23,7g
BTKL: → 27a+24b+45.0,3=23,7 (2)
Từ (1), (2) ta được: →{a=0,2
b=0,2mol
⇒ %mAl=0,2.27\0,2.27+0,2.24.100%=52,94%→%mMg=47,06%
Xét 6,72 lít hỗn hợp X. Gọi số mol O2O2 và Cl2Cl2 lần lượt là x, y mol.
\(n_{hh}=0,3\left(mol\right);\overline{M}=22,5.2=45\)
Khi đó ta có hpt:
\(\left\{{}\begin{matrix}x+y=0,3\\\overline{M}=\frac{32x+71y}{x+y}=45\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{O2}=\frac{0,2.32}{0,2.32+0,1.71}.100\%=47,4\%\)
\(\Rightarrow\%m_{Cl2}=100\%-47,4\%=52,6\%\)
Gọi số mol Al và Mg lần lượt là a, b mol →số mol AlCl3 và MgCl2 lần lượt là a, b mol →
Các quá trình cho và nhận e:
\(Al^o\rightarrow Al^{+3}+3e;Mg^o\rightarrow Mg^{+2}+2e\)
\(O_2+4e\rightarrow2O^{2-};Cl_2+2e\rightarrow2Cl^-\)
Bảo toàn e:
\(3a+2b=0,2.4+0,1.2=1\left(1\right)\)
Mà hỗn hợp clorua và oxit của hai kim loại có khối lượng 23,7g
BTKL:
\(\Rightarrow27a+24n+45.0,3=23,7\left(2\right)\)
\(\left(1\right)+\left(2\right)\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\b=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Al}=\frac{0,2.27}{0,2.27+0,2.44}.100\%=52,94\%\)
\(\Rightarrow\%m_{Mg}=100\%-52,94\%=47,06\%\)

- Từ giả thiết tính được : n Cl 2 = 0,035 mol; n O 2 = 0,025 mol
Theo ĐLBT khối lượng :
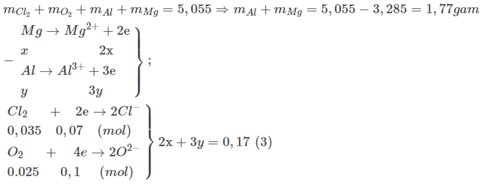
Từ (3)(4) ⇒ x = 0,04; y = 0,03
⇒ m Mg = 0,04.24 = 0,96g; m Al = 0,03.27 = 0,81g
Phản ứng không oxi hoá - khử

\(n_{Mg}=\dfrac{4,08}{24}=0,17\left(mol\right)\)
\(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
Gọi số mol Cl2 và O2 là a, b
Mg0-2e-->Mg+2
0,17->0,34
Al0-3e-->Al+3
0,1->0,3
Cl20 +2e--> 2Cl-
a--->2a
O20 +4e --> 2O2-
b--->4b
Bảo toàn e: 2a + 4b = 0,64
Có \(\dfrac{71a+32b}{a+b}=23,8.2=47,6\)
=> a = 0,08; b = 0,12
=> mZ = 4,08 + 2,7 + 0,08.71 + 0,12.32 = 16,3 (g)

Đáp án D
Có

m g X + HNO3 đặc nguội → 0,1 mol NO2
→ BTe a . n M = 0 , 1 m o l ( 2 )
Từ (1) và (2) suy ra:
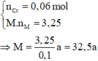
=> a = 2, M = 65 (M là Zn).

gọi x là mol của O2 y là mol của Cl2 ta có hệ pt
pt 1 x+y=0,3 pt2 32x+71y=0,3*2*22,5 --> x=0,2, y=0,1 từ đó tíh khối lượng và % các chất trong X
Gọi mol của Al là a , mol của Mg là b bảo toàn e ta có pt1:3a+2b= nO2*4+nCl2*2 pt2: 27a+24b=(23,7-mh2X) giải tinh đc a và b
mhỗn hợp X tính ở phần pt 2 chỗ phần đầu ý pn
Chúc bạn học tốt
cho mình hỏi số mol 0,3 lấy ở đâu ra ạ
mình không hỉu