Có dung dịch chứa các anion: CO32- và SO42-. Hãy nêu cách nhận biết từng ion trong dung dịch đó. Viết phương trình hóa học.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nhỏ từ từ dung dịch HCl vào mẫu thử thấy có khí thoát ra, thu khí cho vào dung dịch Ca(OH)2 thấy có kết tủa trắng, khí đó là CO2, dung dịch ban đầu có chứa ion CO32-
2HCl + CO32- → CO2 ↑ + H2O + 2Cl-
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Cho dung dịch BaCl2 vào mẫu thử thấy có kết tủa trắng là BaSO4, trong dung dịch có chứa SO42-
SO42- + BaCl2 → BaSO4 ↓ + 2Cl-.

Cho muối BaCl2 vào hai mẫu thử, mẫu thử nào có kết tủa trắng là chứa CO32-
BaCl2 + CO32- → BaCO3 ↓ + 2Cl-
Cho một vài mẫu bột Cu vào mẫu thử còn lại thêm vài giọt H2SO4 (l) nếu thấy thoát ra khí không màu (NO) hóa nâu đỏ (NO2) ngoài không khí thì mẫu thử đó chứa NO3-
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO↑ + 4H2O
2NO + 2O2 → NO2 (màu nâu đỏ)

Đáp án A
Các ion muốn tồn tại thì không phản ứng với nhau tạo chất kết tủa, chất khí hoặc chất điện li yếu.
Ở đáp án A từng cặp ion không phản ứng với nhau tạo chất kết tủa, chất khí, chất điện li yếu nên tồn tại 4 dung dịch đó.
Ở đáp án B có AgCl là chất kết tủa
Ở đáp án C có Al2(CO3)3 không tồn tại, bị thủy phân ngay theo phương trình
Al2(CO3)3+ 3H2O→ 2Al(OH)3+ 3CO2
Ở đáp án D có Ag2CO3 là chất kết tủa

Đáp án A
BaCO3 ↓ ⇒ B không thỏa mãn.
PbSO4 ↓ ⇒ C không thỏa mãn.
PbCl2 ↓ ⇒ D không thỏa mãn.
Đáp án A.

Đáp án D
Do Pb2+ kết hợp được với các ion SO42-, CO32-, Cl- tạo kết tủa
Pb2++ SO42- → PbSO4↓
Pb2++ CO32- → PbCO3↓
Pb2++ 2Cl- → PbCl2↓
nên chắc chắn phải có dung dịch Pb(NO3)2 (do Pb2+ và NO3- không phản ứng với nhau nên hai ion này cùng tồn tại trong một dung dịch).
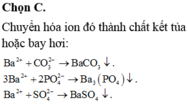
Cho qua dd HCl \(\Rightarrow\)dan sp qua dd nuoc voi trrong : hien tuong lam van duc nuoc voi trong: nhan CO32- , con lai k hien tuong thi la SO4-
CO32- + H+ \(\rightarrow\) CO2\(\uparrow\) + H2O
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O