Nung nóng m gam hỗn hợp gồm Al,Fe2O3 trong môi trường không có không khí.Sau khi phản ứng xảy ra hoàn toàn,thu được hỗn hợp rắn Y.Chia Y thành 2 phần bằng nhau
Phần 1 tác dụng với dung dịch H2SO4 loãng dư sinh ra 3,08 lít khí H2 đktc.
Phần 2 tác dụng với dung dịch NaOH dư sinh ra 0,84 lít khí H2 đktc.
Tính m

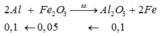

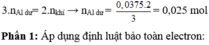
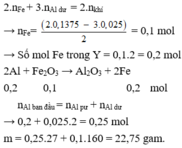

Phần 2: do tác dụng với NaOH dư sinh ra H2 => Al dư
n H2 = 0,84 / 22,4 = 0,0375
Al + NaOH + H2O = NaAlO2 + 3/2 H2
0,025....................................
=> n Al dư = 0,025
Phần 1: n H2 = 3,08 / 22,4 = 0,1375
Al + 3H2SO4 = Al2(SO4)3 + 3H2
0,025_________________0,075
Fe + H2SO4 = FeSO4 + H2
0,0625..........................0,0625
* n Al2O3 = n Fe = 0,0625 => n Al phản ứng = 0,125
=> n Al = 0,125 + 0,025 = 0,15 => m Al = 4,05 (g)
* n Fe2O3 = n Fe/2 = 0,03125 => m Fe2O3 = 5 (g)
=> m hh = 2(m Fe + m Al) = 2(5 + 4,05) = 18,1 (g)
\(2Al+Fe_2O_3\rightarrow2Fe+Al_2O_3\)
Vậy chất rắn Y là \(Al_2O_3\) ;Fe và Al dư
Phần 1 \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\) (2)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\) (3)
\(n_{H_2}=0,1375\left(mol\right)\)
Phần 2 \(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\) (4)
\(2Al+2H_2O+2NaOH\rightarrow2NaAlO_2+H_2\uparrow\) (5)
\(n_{H_2}=\dfrac{0,84}{22,4}=0,0375\left(mol\right)\)
Theo (5) \(n_{Al}=0,025\left(mol\right)\)
Theo (2) và (1) \(n_{H_2}=0,1\left(mol\right)\Rightarrow n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow\)\(\sum n_{Fe}=0,1\left(mol\right)\rightarrow m_{Fe_2O_3}=0,1\times160=16\left(g\right)\)
\(\sum n_{Al}=\left(0,2+0,05\right)\times27=6,75\left(g\right)\)
Vậy \(m=16+6,75=22,75\left(g\right)\)