Hòa tan 3,6g một kim loại (chỉ có một hóa trị duy nhất trong hợp chất) vào 200ml dung dịch hỗn hợp HCl 1,25M và H2SO4 1,5M. Dung dịch thu được sau phản ứng làm đỏ quỳ tím và phải trung hòa bằng 100ml dung dịch hỗn hợp NaOH 2,5M và Ba(OH)2 1,5M. Xác định kim loại.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án D
► Xử lý dữ kiện 200 ml dung dịch Y: nH+ = 0,2 × (0,2 + 0,15 × 2) = 0,1 mol.
pH = 13 ⇒ OH– dư ⇒ [OH–] = 1013 – 14 = 0,1M ⇒ nOH– dư = 0,4 × 0,1 = 0,04 mol.
||⇒ nOH–/Y = 0,04 + 0,1 = 0,14 mol ⇒ 400 ml dung dịch Y chứa 0,28 mol OH–.
► Dễ thấy nOH– = 2nH2 + 2nO/oxit ⇒ nO/oxit = (0,28 – 2 × 0,07) ÷ 2 = 0,07 mol.
||⇒ m = 0,07 × 16 ÷ 0,0875 = 12,8(g)

Đáp án B
Zn có tính khử mạnh hơn Fe, Zn sẽ phản ứng với dung dịch CuSO4 trước.
Theo đề: hỗn hợp rắn Z phản ứng với dung dịch H2SO4 loãng thu được 1 muối duy nhất → trong hỗn hợp rắn Z có Cu và Fe dư. Vậy mFe dư = 0,28 (g) và mCu = 2,84 - 0,28 = 2,56 (g)
Ta có: khối lượng hỗn hợp X phản ứng với Cu2+ = 2,7 - 0,28 = 2,42 (g)
Gọi nZn = x mol; nFe pư = y mol
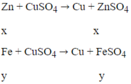
Ta có hệ:
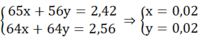
mFe ban đầu = 0,02.56 + 0,28 = 1,4 (g)
![]()

Đáp án C
Ta có: ![]()
suy ra số mol CO2 trong Z là 0,05 mol tức O bị khử 0,05 mol.
Gọi số mol Fe3O4 và CuO lần lượt là a, b
![]()
Cho Y tác dụng với 1,2 mol HNO3 thu được khí 0,175 mol khí NO2.
Bảo toàn N:
![]()
![]()
Ta có 2 TH xảy ra:
TH1: HNO3 dư.
![]()
![]()
TH2: HNO3 hết.
![]() nghiệm âm loại.
nghiệm âm loại.

Đáp án C
Ta có: n B a C O 3 = 0 , 05 m o l suy ra số mol CO2 trong Z là 0,05 mol tức O bị khử 0,05 mol.
Gọi số mol Fe3O4 và CuO lần lượt là a, b => 232a+80b= 25,4
Cho Y tác dụng với 1,2 mol HNO3 thu được khí 0,175 mol khí NO2.
Bảo toàn N: n N O 3 - t r o n g Y = 1 , 2 - 0 , 175 = 1 , 025 m o l = n N a O H → V = 1 , 025
Ta có 2 TH xảy ra:
TH1: HNO3 dư
a+0,05.2=0,175 =>a=0,075=> b= 0,1 → % F e 3 O 4 = 68 , 5 %
TH2: HNO3 hết
8a+2b-0,05.2+0,175.3= 1,025 nghiệm âm loại.

Đáp án B
Do sau phản ứng vẫn còn chất rắn nên Fe và Cu hoặc cả Fe và Cu đều còn. Khi Fe hoặc Cu còn thì Fe3+ đã chuyển hoàn toàn thành Fe2+.
