Để hòa tan 28,2g hỗn hợp gồm ZnO, MgO và Fe2O3 cần dùng 328,5g đd Hcl 10%. Sau phản ứng thu được dung dịch B đem dung dịch B đi khô cạn được m(g) muối khan. Tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Gọi n Zn = a(mol) ; n ZnO = b(mol)
=> 65a + 81b = 14,6(1)
$Zn + 2HCl \to ZnCl_2 + H_2$
$ZnO + 2HCl \to ZnCl_2 + H_2O$
n ZnCl2 = a + b = 27,2/136 = 0,2(2)
Từ (1)(2) suy ra : a = b = 0,1
%m Zn = 0,1.65/14,6 .100% = 44,52%
%m ZnO = 100% -44,52% = 55,45%
b)
n HCl = 2n Zn + 2n ZnO = 0,4(mol)
m dd HCl = 0,4.36,5/7,3% = 200(gam)

Chọn A
Cần nhớ phản ứng cho oxit bazơ tác dụng với H 2 S O 4 thì:


Đáp án D
Số mol H2SO4 là: n H 2 SO 4 = 0 , 5 . 0 , 1 = 0 , 05 mol
Gọi M2On là oxit chung cho các oxit trong X
Sơ đồ phản ứng :
![]()
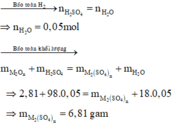

nH2O=nH2SO4=0,2.1=0,2(mol)
=> nSO42- = nO2- = 0,2(mol)
m(muối)= m(hhA) - mO2- + mSO42-= 16 - 0,2.16+ 96/.0,2= 32(G)
=>chọn A

Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
Al2O3 + 6HCl --> 2AlCl3 + 3H2O
MgO + 2HCl --> MgCl2 + H2O
Bảo toán H: nHCl = 2.nH2O (1)
Áp dụng ĐLBTKL:
\(m_A+m_{HCl}=m_M+m_{H_2O}\)
=> \(36,5.n_{HCl}-18.n_{H_2O}=73,8-40,8=33\) (2)
(1)(2) => nHCl = 1,2 (mol)
=> Vdd = \(\dfrac{1,2}{0,6}=2\left(l\right)\)

\(\left\{{}\begin{matrix}n_{HCl}=0,2.4=0,8\left(mol\right)\\n_{HBr}=0,2.2=0,4\left(mol\right)\end{matrix}\right.\)
=> \(n_{H_2O}=0,6\left(mol\right)\)
=> nO = 0,6 (mol)
=> mkim loại = 34,8 - 0,6.16 = 25,2 (g)
=> mmuối = 25,2 + 0,8.35,5 + 0,4.80 = 85,6 (g)


mHCl=328,5.10%=32,85g
=>nHCl=0,9 mol
nH2=1/2 nHCl=0,45 mol
Bảo toàn klg=>m muối sau=mhh oxit+mHCl-mH2
=28,2+0,9.36,5-0,45.2=60,15g
ta có mHCl=(10*328.5)/100=32.85(g)
=>nHCl=0.9(mol)
=>nH2=0.45(mol)
=>mH2=0.9(g)
ADĐLBTKL,ta có:
mhh+mHCl=mmuoikhan+mH2
=>mmuoikhan=28.2+32.85-0.9=60.15
OK