Tính theo PTHH, lượng dư, Nồng độ dung dịch?cho 11,2g sắt tác dụng với 400ml dung dịch HCLa, Tính thể tích H2 sinh ra ở đktc?b, Tính nồng độ mol của dung dịch HCL đã dùng ?c, Nếu dùng lượng H2 của phản ứng trên khử 8g CuO ở nhiệt độ cao. Hỏi thu đc bao nhiêu gam FeTrả...
Đọc tiếp
Tính theo PTHH, lượng dư, Nồng độ dung dịch?
cho 11,2g sắt tác dụng với 400ml dung dịch HCL
a, Tính thể tích H2 sinh ra ở đktc?
b, Tính nồng độ mol của dung dịch HCL đã dùng ?
c, Nếu dùng lượng H2 của phản ứng trên khử 8g CuO ở nhiệt độ cao. Hỏi thu đc bao nhiêu gam Fe
Trả Lời
nFe=11.2\56=0.2(o)nFe=11.2\56=0.2(mol)
+
0.2.......0.4...................0.2
VH2=0.2⋅22.4=4.48(l)VH2=0.2⋅22.4=4.48(l)
CMHCl=0.4\0.4=1(M)CMHCl=0.4\0.4=1(M)
nCuO=8\80=0.1(mol)nCuO=8\80=0.1(mol)
CuO+H2t0→Cu+H2OCuO+H2t0→Cu+H2O
1............11............1
0.1.........0.20.1.........0.2
LTL:0.11<0.21⇒H2dưLTL:0.11<0.21⇒H2dư
nCu=nCuO=0.1(mol)nCu=nCuO=0.1(mol)
mCu=0.1⋅64=6.4(g)
CHO HỎi
NFe = 11.2\56 = 0,2 mol thì 56 lấy đâu ra ạ

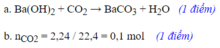
a.Ta có: nHCl=1.\(\frac{200}{1000}\)=0,2(mol)
Ta có phương trình 2Al + 6HCl -----> 2AlCl3 + 3H2 (1)
Theo phương trình: 2 mol 6 mol 3 mol
Theo đề: x mol 0,2 mol 0,1 mol
=> V\(H_2\)=0,1.22,4=2,24(l)
b. Từ pt (1), ta có:
mAl=x.27=\(\frac{0,2.2}{6}\).27=1,8(g)
c.Từ pt (1), ta có: mHCl=0,2. (1+35,5)=7,3(g)
mdd=\(\frac{200}{1000}.22,4.18=80,64\left(g\right)\)
=>C%=\(\frac{7,3}{80,64}.100\%=9,1\%\)
Ungr hộ nha!