Hoà tan 0.1 mol fes2 trong 200ml dd hno3 4M ,sản phẩm thu đc gồm dung dịch x và 1 chất khí thoát ra. Dung dịch x có thể hoà tan tối đa m gam cu . Biết trong quá trình trên ,sản phẩm khử duy nhất của n+5 là no. Tính giá trị m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Vì phản ứng chỉ thu được một khí duy nhất và sản phẩm khử duy nhất là khí NO nên sản phẩm trong phản ứng tương ứng với S trong FeS2 là S O 4 2 - tồn tại trong dung dịch.
Có phản ứng xảy ra như sau:
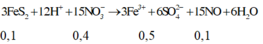
Khi đó dung dịch thu được chứa 0,1 mol Fe3+, 0,4 mol H+ và 0,3 mol N O 3 -
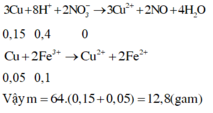

Đáp án A
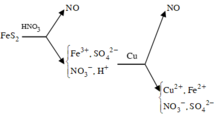
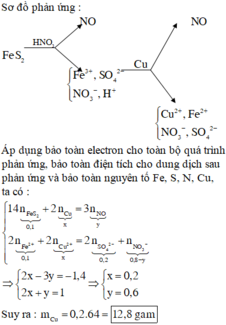
Sơ đồ phản ứng :
Áp dụng bảo toàn electron cho toàn bộ quá trình phản ứng, bảo toàn điện tích cho dung dịch sau phản ứng và bảo toàn nguyên tố Fe, S, N, Cu, ta có :
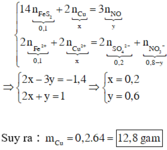

Đáp án A
0,1 mol FeS2 + 0,8 mol HNO3 → dd X + ↑NO x mol.
ddX + tối đa m gam Cu y mol.
- Bản chất của phản ứng là quá trình nhường, nhận electron:
FeS2 → Fe+2 + 2S+6 + 14e
Cu → Cu+2 + 2e
N+5O3- + 4H+ + 3e → N+2O + 2H2O
Theo bảo bảo electron: 14 × nFeS2 + 2 × nCu = 3 × nNO → 14 × 0,1 + 2y = 3x (*)
- Sau phản ứng trong dung dịch có Fe+2; Cu+2; NO3-; SO4-2
Theo bảo toàn điện tích 2 × nFe+2 + 2 × nCu+2 = 1 × nNO3- + nSO4-2
→ 2 × 0,1 + 2y = 3x + 0,1 × 2 (**)
Từ (*) và (**) → x = 0,6; y = 0,2 → mCu = 0,2 × 64 = 12,8 gam

Đáp án : D
FeS2 + HNO3 -> Fe
FeS2 -> Fe3+ + 2S+6 + 15e
N+5 + 3e -> N+2
Bảo toàn e : 15 n F e S 2 = 3nNO
=> nNO = 0,75 mol
=> n N O 3 - s a u = 1,2 – 0,75 = 0,45 mol
Trong dung dịch sau có : Fe3+ ; H+ ; SO42- ; NO3-
Bảo toàn điện tích : 3.0,15 + nH+ = 2.0,3 + 0,45
=> n H + = 0,6 mol
3Cu + 8H+ + 2NO3- -> 3Cu2+ + 2NO + 4H2O
2Fe3+ + Cu -> 2Fe2+ + Cu2+
=> nCu = 0,5 n F e 3 + + 3/8 n H + = 0,3 mol
=> m = 19,2g

Đáp án C
Quy đổi hỗn hợp về Fe (x mol); Cu (y mol) và S (z mol)
Bảo toàn S có
nS = n↓ = 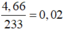 (mol)
(mol)
mX = 2,72 gam → 56x + 64y + 0,02.32 = 2,72 → 56x + 64y = 2,08 (1)
Do Y có thể hòa tan được Cu, bảo toàn electron có:
3.nFe + 2.nCu + 6.nS = 3.0,07 → 3x + 2y = 0,09 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,015.
Dung dịch Y gồm: Fe3+: 0,02 mol; Cu2+: 0,015 mol; SO42- = 0,02 mol; NO3- = (0,5 – 0,07 = 0,43 mol) và có thể có H+
Bảo toàn điện tích → nH+ = 0,38 mol
Cho Cu vào Y có phản ứng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,1425 ← 0,38 0,43 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,01 ← 0,02 mol
m = (0,01 + 0,1425).64 = 9,76 gam.
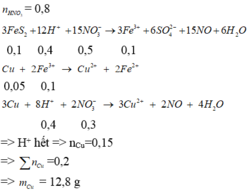

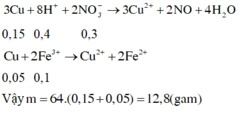

lien