1,1g hỗn hợp bột Fe và Bột Al tác dụng vừa đủ với 1,28g lưu huỳnh
Tính tỉ lệ phần trăm của Fe và Al tron hỗn hợp ban đầu theo khối lượng chất và lượng chất
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi nFe = x mol, theo PT ⇒ nS (1) = nFe = x mol
Gọi nAl = y mol, theo PT ⇒ nS (2) = 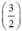 . nAl =
. nAl = 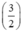 . y mol
. y mol
⇒ nS = x + 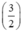 . y = 0,04 mol.
. y = 0,04 mol.
mhh = 56x + 27y = 1,1.
Giải hệ phương trình ta có x = 0,01 mol, y= 0,02 mol.
Tỉ lệ % sắt và nhôm trong hỗn hợp theo lượng chất ( theo số mol là):
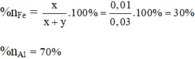
Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp theo khối lượng chất:
mAl = 0,02 x 27 = 0,54g
mFe = 0,01 x 56 = 0,56g.
%mAl = 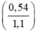 × 100% = 49,09%
× 100% = 49,09%
%mFe = 100% - 49,09% = 50,91%

a)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có (mol).
Ta có hệ phương trình :
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl = %.
%mFe = 50,91 %.
Theo lượng chất :
%nAl = 66,67%.
%Fe = 33,33%.
)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có
(mol).
Ta có hệ phương trình :
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl =
%.
%mFe = 50,91 %.
Theo lượng chất :

Fe + S → FeS
x x (mol)
2Al + 3S → t ° Al 2 S 3
y 3y/2(mol)
Đặt số mol Fe, Al lần lượt là x,y ta có hệ phương trình:
56x + 27y = 1,1
(x +3y/2).32 = 1,28
Giải ra x = 0,01 và y = 0,02
% n Fe = 0,01/0,03 x 100% = 33,33%; % n Al = 100 - 33,33% = 66,667%
% m Fe = 56.0,01/1,1 x 100% = 50,90%; % m Al = 100 - 50,90 = 49,1 (%)

a. Fe + S \(\rightarrow\) FeS
2Al + 3S \(\rightarrow\) Al2S3
b. Gọi x, y lần lượt là số mol của sắt và nhôm ta có:
PT: Fe + S \(\rightarrow\) FeS
theo đề x(mol) x(mol)
2Al + 3S \(\rightarrow\) Al2S3
y(mol) (3/2)y (mol)
Theo đề bài ta có hệ: 56x + 27y = 1,1
x + (3/2)y = 1,28/32= 0.04
Giải hệ ta được x= 0.01; y=0.02
KHối lượng sắt trong hỗn hợp là:56x = 56x0.01=0.56 g
+> %Fe=(0.56/1.1)x100%= 50.9%
=> %Al= 100% - 50.9% = 49,1%

\(Fe+S\rightarrow FeS\) (1)
a-----a-------a---------(mol)
\(2Al+3S\rightarrow Al_2S_3\) (2)
b------1,5b----0,5b-----(mol)
Ta có hệ PT sau:
\(\left\{{}\begin{matrix}56a+27b=1,1\\32a+48b=1,28\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,01\\b=0,02\end{matrix}\right.\)
=> mFe=0,01.56=0,56gam
mAl=0,02.27=0,54gam
\(\%Fe=\dfrac{0,56}{1,1}.100\%\approx51\%=>\%Al=100-51=49\%\)
vậy...
Ta có : \(n_S=\dfrac{m}{M}=\dfrac{1,28}{32}=0,04\left(mol\right)\)
Gọi x, y lần lượt là số mol của Fe và Al trong hỗn hợp
\(\Rightarrow m_{Fe}+m_{Al}=56x+27y=1,10=1,1\left(g\right)\)(1 )
a) PTHH :
Fe + S \(\rightarrow^{t^o}\)FeS
x-----x
2Al + 3S \(\rightarrow^{t^o}Al_2O_3\)
y------1,5y
\(\Rightarrow x+1,5y=0,04\) ( 2 )
Từ ( 1 ) và ( 2 ) , ta có hệ phương trình :
\(\left\{{}\begin{matrix}56x+27y=1,1\\x+1,5y=0,04\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,01\\y=0,02\end{matrix}\right.\)
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu :
* Theo lượng chất
\(\%n_{Fe}=\dfrac{0,01\cdot100\%}{0,01+0,02}=33,33\%\)
\(\%n_{Al}=\dfrac{0,02\cdot100\%}{0,01+0,02}=66,67\%\)
* Theo khối lượng chất
\(\%m_{Fe}=\dfrac{m_{Fe}\cdot100\%}{m_{hh}}=\dfrac{0,01\cdot56\cdot100\%}{1,1}=51\%\)
\(\%m_{Al}=100\%-\%Fe=100\%-51\%=49\%\)
Mong là đúng

a)
Gọi $n_{Fe} = a(mol) ; n_{Al} = b(mol) \Rightarrow 56a + 27b = 11(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
Theo PTHH :
$n_{HCl} = 2a + 3b = 0,4.2 = 0,8(2)$
Từ (1)(2) suy ra a = 0,1 ; b = 0,2
$\%m_{Fe} = \dfrac{0,1.56}{11}.100\% = 50,91\%$
$\%m_{Al} = 100\%- 50,91\% = 49,09\%$
Fe + S ----> FeS
2Al + 3S ----> Al2S3
Gọi x, y tương ứng là số mol Fe và Al.
56x + 27y = 1,1 và x + 1,5y = 1,28/32 = 0,04
Giải hệ thu được: x = 0,01; y = 0,02 mol.
Vậy: mFe/mAl = 56x/27y = 56/54 = 1,037.
x/y = 1/2.