cần phải dùng 150ml dd HCL a mol/lít để kết tủa hoàn toàn 200g dd AgNo3 8,5%. tính nồng độ dd HCL
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) 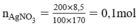
Phương trình hóa học của phản ứng:
HCl + AgNO3 → AgCl + HNO3
Theo pt nHCl = nAgCl = 0,1 mol
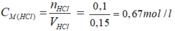
b) 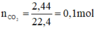
Phương trình hóa học của phản ứng:
HCl + NaHCO3 → NaCl + CO2↑ + H2O
Theo pt: nHCl = nCO2 = 0,1 mol ⇒ mHCl = 0,1. 36,5 = 3,65 g
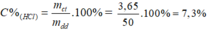

a)
Phương trình hóa học của phản ứng:
HCl + AgNO3 → AgCl + HNO3
Theo pt nHCl = nAgCl = 0,1 mol
b)
Phương trình hóa học của phản ứng:
HCl + NaHCO3 → NaCl + CO2↑ + H2O
Theo pt: nHCl = nCO2 = 0,1 mol ⇒ mHCl = 0,1. 36,5 = 3,65 g ( mình viết ko được rõ )
a.
mAgNO3 = (200.8,5%)/100 =17g
nAgNO3 = 17/170= 0,1 mol
để kết tủa hoàn toàn thì nAgNO3=nHCl = 0,1 mol
CHCl=0,1/0,15=2/3 (M)
b.
HCl + NaHCO3 =====> NaCl + CO2 + H2O
nCO2 = 0,1 mol=nHCl (theo pt)
mHCl =3,65 g
%CHCl = (3,65/50) .100% =7,3%

nNaOH=0,025mol
nH2SO4=0,015mol
2NaOH+H2SO4->Na2SO4+2H2O
Ta có 0,025/2 <0,015/1 =>H2SO4 dư
Khi nhúng quì tím vào dd thì quì tím chuyển sang màu đỏ
2NaOH+H2SO4->Na2SO4+2H2O
0,025 0,0125 0,0125
DD X: H2SO4:0,0025mol
Na2SO4: 0,0125mol
C(H2SO4)=0,00625M
C(NaOH)=0,03125M

1) $n_{NaOH} = 0,015(mol) ; n_{H_2SO_4} = 0,025(mol)$
$2NaOH + H_2SO_4 \to Na_2SO_4 + H_2O$
Ta thấy :
$n_{NaOH} : 2 < n_{H_2SO_4} : 1$ nên $H_2SO_4$ dư
Do đó quỳ tím hóa đỏ.
2)
$n_{Na_2SO_4} = \dfrac{1}{2}n_{NaOH} = 0,0075(mol)$
$n_{H_2SO_4\ dư} = 0,025 - 0,0075 = 0,0175(mol)$
$V_{dd\ X} = 0,15 + 0,25 = 0,4(lít)$
Suy ra :
$C_{M_{Na_2SO_4}} = \dfrac{0,0075}{0,4} = 0,01875M$
$C_{M_{H_2SO_4\ dư}} = \dfrac{0,0175}{0,4} = 0,04375M$
3)
$2KOH + H_2SO_4 \to K_2SO_4 + H_2O$
$n_{KOH} = 2n_{H_2SO_4\ dư} = 0,035(mol)$
$V_{dd\ KOH} =\dfrac{0,035}{1} = 0,035(lít)$
số mol AgNO3 = 0.1 mol ---> nAg+ = 0.1 mol
Ag+ + Cl ----> AgCl ( kết tủa)
0.1 0.1
--> nHCl = 0.1 mol
Cm = n/V = 0.1/0.15 = 0.67M
HCl + AgNO3 ---> AgCl + HNO3.
m(AgNO3) = 17 (g).
---> n(AgNO3) = 0,1 (mol).
---> n(HCl) = 0,1 (mol).
---> nồng độ mol của dd HCl = 0,1 / 0,15 = 0,67 M.