cho 6,72l hỗn hợp khí hidro vá oxi ở đktc có tỉ khối so với hidro=11. gây nổ hỗn hợp bằng tia lửa điện tính khối lượng nước tạo thành biết hiệu suất phản ứng là 90%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nhh = 8.96/22.4 = 0.4 (mol)
nH2 = nO2 = 0.4/2 = 0.2 (mol)
Đặt : nO2 (pư) = x (mol)
2H2 + O2 -to-> 2H2O
Bđ: 0.2____0.2
Pư: 2x_____x______2x
Kt : 0.2-2x__0.2-2x__2x
M = 10*2 = 20 (g/mol)
=> (0.2-2x)*2 + (0.2-2x)*32 + 2x * 18 = (0.2-2x+0.2-2x+2x)*20
=> x = 0.06
H% = 0.06*2/0.2 * 100% = 60%
\(n_{hh_1}=\dfrac{V_{hh_1}}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow n_{H_2}=n_{O_2}=0,2\left(mol\right)\)
PTHH: \(2H_2+O_2\rightarrow2H_2O\)
.............2............1................2.........
Sản phẩm sau khi nổ gồm \(H_2O\left(n=2x\right);H_2\left(\text{dư};n=0,2-2x\right);O_2\left(\text{dư};n=0,2-x\right)\)
Mà hỗn hợp khí và hơi có tỉ khối so với H2 là 10 nên:
\(d_{\dfrac{hh_2}{H_2}}=\dfrac{M_{hh_2}}{2}=10\\ \Rightarrow M_{hh_2}=20\left(g/mol\right)\)
Ta có pt: \(18\cdot2x+2\left(0,2-2x\right)+32\left(0,2-x\right)=20\left(2x+0,2-2x+0,2-x\right)\)
Giải pt ta được \(x=0,06\)
\(H=\dfrac{2x}{0,2}\cdot100\%=\dfrac{2\cdot0,06}{0,2}\cdot100\%=60\%\)

nhh1=Vhh122,4=0,4(mol)nhh1=Vhh122,4=0,4(mol)
⇒nH2=nO2=0,2(mol)⇒nH2=nO2=0,2(mol)
PTHH: 2H2+O2→2H2O2H2+O2→2H2O
.............2............1................2.........
Sản phẩm sau khi nổ gồm H2O(n=2x);H2(dư;n=0,2−2x);O2(dư;n=0,2−x)H2O(n=2x);H2(dư;n=0,2−2x);O2(dư;n=0,2−x)
Mà hỗn hợp khí và hơi có tỉ khối so với H2 là 10 nên:
dhh2H2=Mhh22=10⇒Mhh2=20(g/mol)dhh2H2=Mhh22=10⇒Mhh2=20(g/mol)
Ta có pt: 18⋅2x+2(0,2−2x)+32(0,2−x)=20(2x+0,2−2x+0,2−x)18⋅2x+2(0,2−2x)+32(0,2−x)=20(2x+0,2−2x+0,2−x)
Giải pt ta được x=0,06x=0,06
H=2x0,2⋅100%=2⋅0,060,2⋅100%=60%

Đây là một ví dụ rất đơn giản nhưng đặc trưng về quan hệ số mol trong phản ứng cộng hidro của hidrocacbon chưa no
Dễ tính đươc
![]()
Trong phản ứng hidro hóa hidrocacbon chưa no thì số mol khí giảm chính bằng số mol hidro phản ứng suy ra ![]()
Mặt khác đề cho hidrocacbon dư, phản ứng hoàn toàn nên
![]()
suy ra ![]()

2h2+o2→2h2o
nH2=1.12/22.4=0.05(mol)
nO2=1.68/22.4=0.075(mol)
ta có nH2/2=0.05/2=0.025<nO2/1=0.075
→H2 hết ,O2 dư.
theo pt nH2o=nH2=0.05(mol)
mH2o=0.05*18=0.9 (g)
xong![]()

Đáp án C
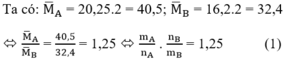
Áp dụng định luật bảo toàn khối lượng ta có: mA = mB
![]()
Giả sử ban đầu có 1 mol hỗn hợp A => nB = 1,25.1 = 1,25 mol
Trong phản ứng đề hidro hóa: số mol hỗn hợp khí sau phản ứng tăng, số mol tăng của hỗn hợp B so với hỗn hợp A chính là số mol các chất phản ứng.
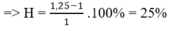

Coi n X = 1(mol)
Gọi n H2 = a(mol) ; n N2 = b(mol)
Ta có :
a + b = 1
2a + 28b = 3,6.2 = 7,2
=> a = 0,8 ; b = 0,2
3H2 + N2 \(\xrightarrow{t^o,xt}\)2 NH3
3a........a..............2a........(mol)
Vì n H2 / 3 > n N2 / 1 nên hiệu suất tinh theo số mol N2
Gọi hiệu suất là a => n N2 pư = a(mol)
m Y = m X = 7,2
=> n Y = 7,2/(4,2826.2) = 0,84(mol)
Sau phản ứng, Y gồm :
H2 : 0,8 - 3a
N2 : 0,2 - a
NH3 : 2a
=> n Y = 0,8 - 3a + 0,2 -a + 2a = 0,84
=> a = 0,08 = 8%

Đáp án : C
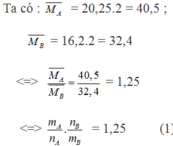
Áp dụng định luật bảo toàn khối lượng ta có: mA = mB
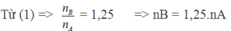
Giả sử ban đầu có 1 mol hỗn hợp A => nB = 1,25.1 = 1,25 mol
Trong phản ứng đề hidro hóa: số mol hỗn hợp sau phản ứng tăng, số mol tăng của hỗn hợp B so với hỗn hợp A chính là số mol các chất phản ứng
=> H = (1,25-1) .100% = 25%
TL:
2H2 + O2 ---> 2H2O
Số mol hh = 6,72/22,4 = 0,3 mol. Khối lượng trung bình hh = 2.11 = 22. Gọi x, y tương ứng là số mol của H2 và O2 trong hh. Ta có hệ:
x + y = 0,3 và 2x + 32y = 22.0,3 = 6,6. Giải hệ thu được x = 0,1; y = 0,2 mol.
Theo pt trên thì O2 dư nên số mol H2O được tính theo số mol H2. Vì hiệu suất là 90% nên số mol H2O = 0,9.0,1 = 0,09 mol. Do đó khối lượng nước = 18.0,09 = 1.62 g.