cho 12,8gam hỗn hợp x gồm FeO và Fe vào dunh dịch H2SO4 loãng, dư. Sau khi các phản ứng xảy ra hoàn toàn thì thu đc 2,24 lít khí ở đktc
a viết phương trình phản ứng xảy ra
b tính thành phần phần trăm theo khối lượng mỗi chất trong hỗn hợp x
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
\(n_{H_2}=n_{Fe}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> \(n_{FeO}=\dfrac{12,8-56.0,1}{72}=0,1\left(mol\right)\)
12,8 g hh X ------> 0,1 mol Fe và 0,1 mol FeO
=> 6,4g hh X ------> 0,05 mol Fe và 0,05 mol FeO
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
2FeO + 4H2SO4 → 4H2O + Fe2(SO4)3 + SO2
=> \(n_{SO_2}=\dfrac{3}{2}n_{Fe}+\dfrac{1}{2}n_{FeO}=0,1\left(mol\right)\)
SO2 + Ca(OH)2→ CaSO3 + H2O
Vì kết tủa nên khối lượng dung dịch giảm : \(m_{thêm}-m_{mất}=0,1.64+0,1.74-0,1.120=1,8\left(g\right)\)
Fe+ H2SO4 -> FeSO4 + H2
0,1___0,1______0,1__0,1(mol)
FeO+ H2SO4-> FeSO4 + H2O
=>mFe= 0,1.56=5,6(g)
=>%mFe=(5,6/12.8).100=43.75%
=>%mFeO=56,25%
6,4gam hh X => Số mol giảm đi 1/2
nFe=0,05(mol)=nCu
PTHH: 2 Fe + 6 H2SO4(đ)-to-> Fe2(SO4)3 + 3 SO2 + 6 H2O
0,05_______0,15__________0,025________0,075(mol)
Cu+ 2 H2SO4(đ) -to-> CuSO4 + SO2 + H2O
0,05___0,1_________0,05____0,05(mol)
=> nSO2=0,125(mol)
PTHH: SO2 + Ca(OH)2 -> CaSO3 + H2O
0,125_______0,125_____0,125(mol)
=> KL dung dịch giảm.
KL giảm:
0,125.64 + 0,125.74 - 0,125.120=2,25(g)
Chúc em học tốt!

\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Fe_3O_4+4H_2SO_4\rightarrow FeSO_4+Fe_2\left(SO_4\right)_3+4H_2O\\ n_{H_2}=n_{Fe}=0,1\left(mol\right)\\ \%m_{Fe}=\dfrac{56.0,1}{17,2}.100=32,56\%\\ \%m_{Fe_3O_4}=100-32,56=67,44\%\)

Đáp án B
Nung X ở nhiệt độ cao:
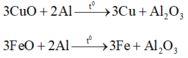
Phần rắn + NaOH dư:
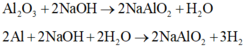
=> Y gồm: Cu, Fe, MgO
Y + H 2 S O 4 loãng dư:
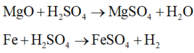
Có tất cả 6 phản ứng xảy ra.

a) Gọi số mol của Al và Fe trong 13,8 gam hỗn hợp lần lượt là x và y
nH2 = 10,08:22.4= 0,45 mol
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
x ------------------------------------------>3/2x
Fe + H2SO4 → FeSO4 + H2
y ------------------------------------> y
Ta có hệ pt\(\left\{{}\begin{matrix}27x+56y=13,8\\\dfrac{3}{2}x+y=0,45\end{matrix}\right.\) => x = 0,2 và y = 0,15
=> mFe = 0,15.56 = 8,4 gam <=> %mFe = \(\dfrac{8,4}{13,8}\).100% = 60,87%
b)
X + O2 → Y
Bảo toàn khối lượng => mO2 = mY - mX = 5,76 gam <=> nO2 = 0,18 mol
Ta có sơ đồ: \(\left\{{}\begin{matrix}Fe\\Al\end{matrix}\right.\) + O2 → Y \(\underrightarrow{H_2SO_4đ,n}\) → Fe2(SO4)3 + Al2(SO4)3 + SO2 + H2O
Các quá trình oxi hóa - khử:
Fe0 → Fe+3 + 3e O20 + 4e → 2O-2
0,15 -> 0,45 0,18 --> 0,72
Al0 → Al+3 + 3e S+6 + 2e → S+4
0,2 -> 0,6 2x <- x
Áp dụng ĐLBT electron => 2x + 0,72 = 0,45 + 0,6
<=> x = 0,165
=>V SO2 đktc = 0,165.22,4 = 3,696 lít

a.\(Fe+S\rightarrow\left(t^o\right)FeS\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
b.\(n_{hhk}=\dfrac{4,48}{22,4}=0,2mol\)
\(Fe+S\rightarrow\left(t^o\right)FeS\)
Ta thu được hh khí --> S hết, Fe dư
Gọi \(\left\{{}\begin{matrix}n_{Fe}=x\\n_S=y\end{matrix}\right.\)
\(\rightarrow n_{FeS}=n_{Fe}=n_S\rightarrow n_{Fe\left(dư\right)}=x-y\) ( mol )
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(x-y\) \(x-y\) ( mol )
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
y y ( mol )
Ta có: \(\left(x-y\right)+y=0,2\)
\(\Leftrightarrow x=0,2\)
Ta có:\(56x+32y=14,4\)
\(\Leftrightarrow56.0,2+32y=14,4\)
\(\Leftrightarrow y=0,1\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{14,4}.100=77,77\%\\\%m_S=100\%-77,77\%=22,23\%\end{matrix}\right.\)
Fe+ H2SO4 -> FeSO4 + H2
0,1___0,1______0,1__0,1(mol)
FeO+ H2SO4-> FeSO4 + H2O
=>mFe= 0,1.56=5,6(g)
=>%mFe=(5,6/12.8).100=43.75%
=>%mFeO=56,25%