Khối lượng NaOH cần dùng để pha chế 250,0 ml dung dịch có pH = 10,0 là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


* Phần tính toán:
Khối lượng dung dịch NaOH: m d d = D.V = 1,1.2000=2200(g)
Khối lượng NaOH có trong 2 lit dung dịch:
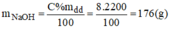
Gọi x(ml) là thể tích của dung dịch NaOH 3% ⇒ m d d = V.d = 1,05.x
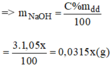
Gọi y(ml) là thể tích của dung dịch NaOH 10% ⇒ m d d = V.d = 1,12.y
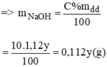
Ta có hệ phương trình sau: 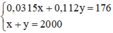
Giải hệ phương trình trên, ta được: 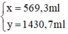
* Cách pha chế:
Đong lấy 569,3ml dung dịch NaOH 3% và 1430,7ml dung dịch NaOH 10% vào bình có dung dịch khoảng 3 lit. Trộn đều ta được 2 lit dung dịch NaOH 8% có khối lượng riêng 1,1g/ml.

\(pH=14+log\left[OH^-\right]=10\)
\(\Rightarrow\left[OH^-\right]=10^{-4}\)
\(n_{NaOH}=10^{-4}\cdot0.3=3\cdot10^{-5}\left(mol\right)\)
\(m_{NaOH}=3\cdot10^{-5}\cdot40=1.2\cdot10^{-3}\left(g\right)\)

\(n_{NaOH}=0,2.2,5=0,5\left(mol\right)\\ m_{NaOH}=0,5.40=20g\\ m_{\text{dd}}=\dfrac{100.20}{40}=50g\)

pH=10
=>pOH=4
=>[OH]=10^-4
=>[NaOH]=10^-4 M
=>nNaOH=3*10^-5
=>mNaOH=0,00069g

a) \(n_{KCl}=0,3.2=0,6\left(mol\right)\)
=> \(m_{KCl}=0,6.74,5=44,7\left(g\right)\)
b) \(m_{NaOH}=20.25\%=5\left(g\right)\)
c) \(S=\dfrac{m_{ct}}{m_{dd}}.100\)
=> \(53,6=\dfrac{m_{MgCl_2}}{100}.100\)
=> mMgCl2 = 53,6 (g)

Ta có: \(pH=14+log\left(OH^-\right)\) \(\Rightarrow log\left(OH^-\right)=-4\)
\(\Rightarrow\left[OH^-\right]=C_{M_{NaOH}}=0,0001\left(M\right)\)
\(\Rightarrow n_{NaOH}=0,0001\cdot0,25=2,5\cdot10^{-5}\left(mol\right)\)
\(\Rightarrow m_{NaOH}=2,5\cdot10^{-5}\cdot40=0,001\left(g\right)\)