Nhúng một thanh Al có khối lượng 5,00 gam vào 100,0 ml dd CuSO4 đến phản ứng hoàn toàn, dd không còn màu xanh của CuSO4. Lấy cẩn thận thanh kim loại ra rửa sạch, sấy khô cân được 6,38 gam. (Giả sử Cu thoát ra bám hết vào thanh kim loại). Tính thể tích nồng độ dd CuSO4 đã lấy và khối lượng Cu bám vào thanh kim loại
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Fe +CuSO4 → FeSO4 + Cu
Khối lượng thanh sắt tăng thêm đúng bằng khối lượng Cu thêm vào trừ đi khối lượng Fe tham gia phản ứng.
Gọi số mol của Fe tham gia phản ứng là x (mol)
Ta có : 64x−56x=51−50=1
=> x=0,125 (mol)
=> n CuSO4 pứ = n Fe(pứ) = 0,125 (mol)
\(CM_{CuSO_4}=\dfrac{0,125}{0,1}=1,25M\)
n FeSO4 = n Fe(pứ) = 0,125 (mol)
\(CM_{FeSO_4}=\dfrac{0,125}{0,1}=1,25M\)

Đáp án C
Ta cớ pứ: Fe + Cu2+ → Fe2+ + Cu.
Đặt nFepứ = a ⇒ nCu = a.
⇒ mCu – mFe pứ = 0,4 Û 8a = 0,8 Û a = 0,05.
⇒ mFeSO4 = 0,05×152 = 7,6 gam

nAgNO3 = 0,2. 1 = 0,2 (mol)
PTHH: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
Theo PTHH: nCu = ½ nAgNO3 = ½. 0,2 = 0,1 (mol)
=> mCu = 0,1.64 = 6,4 (g)
Theo PTHH: nAg = nAgNO3 = 0,2 (mol) => mAg = 0,2.108 = 21,6 (g)
Vì Ag sinh ra đều bám hết vào thanh đồng => khối lượng thanh đồng tăng số gam là :
∆ = mAgsinh ra - mCu pư = 21,6 – 6.4 = 15,2 (g)

a)
\(Fe_2\left(SO_4\right)_3+Zn\rightarrow2FeSO_4+ZnSO_4\)
\(CuSO_4+Zn\rightarrow ZnSO_4+Cu\downarrow\)
\(FeSO_4+Zn\rightarrow ZnSO_4+Fe\downarrow\)
b)
\(m_O=\dfrac{83,6.45,934}{100}=38,4\left(g\right)\)
=> \(n_O=\dfrac{38,4}{16}=2,4\left(mol\right)\)
=> \(n_{SO_4}=\dfrac{2,4}{4}=0,6\left(mol\right)\)
=> \(n_{ZnSO_4}=0,6\left(mol\right)\)
=> \(n_{Zn\left(pư\right)}=0,6\left(mol\right)\)
\(m_{Fe,Cu}=83,6-0,6.96=26\left(g\right)\)
mthanh KL (sau pư) = 100 + 26 - 0,6.65 = 87(g)

Đáp án C
nCuSO4 = 0,2. 0,5 = 0,1 (mol) ; Gọi nFe phản ứng = x (mol)
PTHH: Fe + CuSO4 → FeSO4 + Cu ↓
Theo PTHH 56x 64x
Khối lượng kim loại tăng ∆ = (64x -56x)= 8x (g)
Theo đề bài ∆m tăng = ( 100,4 -100) = 0,4 (g)
=> 8x = 0,4
=> x = 0,05 (mol)
=> mFeSO4 = 0,05. 152 = 7,6 (g)
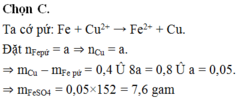
\(n_{Al}=a\left(mol\right)\)
\(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
\(a.........1.5a...................1.5a\)
\(m_{tăng}=m_{Cu}-m_{Al}=64\cdot1.5a-27a=6.38-5\left(g\right)\)
\(\Rightarrow a=0.02\)
\(V_{dd_{CuSO_4}}=\dfrac{0.02\cdot1.5}{0.1}=0.3\left(l\right)\)
\(m_{Cu}=0.02\cdot1.5\cdot64=1.92\left(g\right)\)