Dung dịch X chứa các ion: Ba2+, Na+, HCO3-, Cl-. Chia thành 3 phần bằng nhau: Phần 1: tác dụng với dung dịch AgNO3 dư thu được 11,48gam. Phần 2: tác dụng với Ba(OH)2 dư thu được 15,76gam kết tủa Phần 3: tác dụng với NaOH dư thu được 9,85gam kết tủa Nếu đun sôi đến cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : C
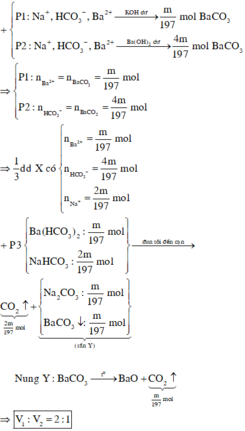
Do P2 phản ứng tạo nhiều kết tủa hơn => Số mol Ba2+ < số mol HCO3-
=> nBa2+ = m 197 mol ; nHCO3- = 4. m 197 mol
Khi đun sôi đến cạn :
2HCO3- à CO2 + CO32- + H2O
=> nCO2(1) = ½ nHCO3- = 2. m 197 mol
Khi nhiệt phân : BaCO3 à BaO + CO2
=> nCO2(2) = nBa2+ = m 197 mol
=> v 1 v 2 = 2 m 197 m 197 = 2 1

Đáp án C
Gọi số mol mỗi ion NH4+, Na+, CO32-, SO42- trong mỗi phần lần lượt là x, y, z , t mol
Phần 1: Ba2++ CO32-→ BaCO3
z z
Ba2++ SO42- → BaSO4
t t
NH4++ OH-→ NH3+ H2O
x x = PV/RT= 0,02 mol
mkết tủa = mBaCO3+ mBaSO4 = 197z+233t = 4,3 suy ra t = 0,01 mol
Phần 2: 2H++ CO32- → CO2+ H2O
z mol z mol = 0,01
Định luật bảo toàn điện tích: x+y = 2z+ 2t suy ra y = 0,02 mol
mmuối = (18x+ 23y+60z+96t).2 = 4,76 gam

Nhận thấy lượng kết tủa thu được khi cho vào NaOH nhỏ hơn khi cho X vào Ba(OH)2
→ n(Ba2+) < n(HCO3-)
Trong phần 1 → n(Ba2+) = 9,85 : 197 = 0,05 mol
Trong phần 2 → n(HCO3-) = 15,76 : 197 = 0.08 mol
Bảo toàn điện tích → n(Na+) = 0,08 + 0,12 – 0,05.2 = 0,1 mol
Khi đun sôi thu được muối chứa Na+ : 0,1 mol, Ba2+ : 0,08 mol, Cl- : 0,12 mol, CO3- : 0,04 mol
→ m = 2.(0,1.23 + 0,05.137 + 0,12.35,5 + 0,04.60) = 31,62 gam
→ Đáp án C
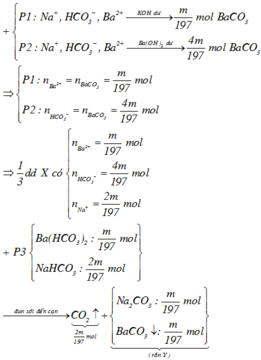
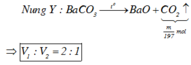
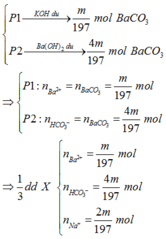
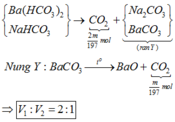

\(P1:\)
\(Ag^++Cl^-\rightarrow AgCl\)
\(n_{AgCl}=n_{Cl^-}=\dfrac{11.48}{143.5}=0.08\left(mol\right)\)
\(P2:\)
\(n_{BaCO_3}=0.08\left(mol\right)\Rightarrow n_{HCO_3^-}=0.08\left(mol\right)\)
\(P3:\)
\(OH^-+HCO_3^-\rightarrow CO_3^{2-}+H_2O\)
\(Ba^{2+}+CO_3^{2-}\rightarrow BaCO_3\)
\(n_{BaCO_3}=\dfrac{9.85}{197}=0.05\left(mol\right)\Rightarrow n_{Ba^{2+}}=0.05\left(mol\right)\)
Bảo toàn điện tích :
\(n_{Na^+}=0.08+0.08-0.05\cdot2=0.06\left(mol\right)\)
\(m=3\cdot\left(0.08\cdot35.5+0.08\cdot61+0.05\cdot137+0.06\cdot23\right)=47.85\left(g\right)\)