Có 190 ml đ chứa đồng thời KOH và Ba(OH)2 có nồng độ 3M và 4M . Tính thể tích dung dich chứa đồng thời HCl 1.98M và H2SO41.1M đủ để trung hòa lượng dung dịch trên. Tính m kết tủa
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


n H + = n OH - → 0,5.(1,98 + 1,1.2) = V.(3 + 4.2) → V = 0,19 lít
Đáp án D

a)
Gọi thể tích hai bazo là V
Suy ra :
n NaOH = 0,1V ; n Ba(OH)2 = 0,15V
n HCl = 0,2.0,2 = 0,04(mol) ; n H2SO4 = 0,2.0,1 = 0,02(mol)
Bản chất của phản ứng là H trong axit tác dụng với OH trong bazo tạo thành nước :
$H + OH \to H_2O$
n H = n HCl + 2n H2SO4 = 0,08(mol)
n OH = n NaOH + 2n Ba(OH)2 = 0,4V
Theo PTHH :
n H = n OH <=> 0,08 = 0,4V <=> V = 0,2(lít)
b) Dung dịch sau pư có :
Na+ : 0,02
Ba2+ :
Cl- : 0,04
Bảo toàn điện tích => n Ba2+ = 0,01(mol)
=> n BaSO4 = n Ba(OH)2 - n Ba2+ = 0,03 - 0,01 = 0,02
m BaSO4 = 0,02.233 = 4,66 gam
vì sao lại có đoạn này vậy ạ :
n H = n HCl + 2n H2SO4 = 0,08(mol)

Đáp án A
Gọi thể tích dung dịch X là V (lít)
nNaOH = 1,5V
nKOH = V
nOH- = 1,5V+V = 2,5V
nH+ = nHCl + 2nH2SO4 = 0,2.0,1 + 2.0,2.0,2 = 0,1 mol
nOH- = nH+ => 2,5V = 0,1
=> V = 0,04 lít = 40 ml

Đáp án A
Gọi thể tích dung dịch X là V (lít)
nNaOH = 1,5V
nKOH = V
nOH- = 1,5V+V = 2,5V
nH+ = nHCl + 2nH2SO4 = 0,2.0,1 + 2.0,2.0,2 = 0,1 mol
nOH- = nH+ => 2,5V = 0,1 => V = 0,04 lít = 40 ml

Chọn A
Gọi thể tích dung dịch X là V (lít)
nNaOH = 1,5V
nKOH = V
nOH- = 1,5V+V = 2,5V
nH+ = nHCl + 2nH2SO4 = 0,2.0,1 + 2.0,2.0,2 = 0,1 mol
nOH- = nH+ => 2,5V = 0,1 => V = 0,04 lít = 40 ml
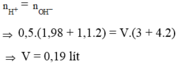
Ta có : \(n_{OH}=2C_{MBa\left(OH\right)2}V+C_{MKOH}V=2,09\left(mol\right)\)
\(BTNT\left(O\right):n_{H2O}=n_{OH}=2,09\left(mol\right)\)
\(BTNT\left(H\right):n_H=n_{H2O}=2,09\left(mol\right)\)
Mà \(n_H=2,09=1,98V+2,2V=4,18V\)
\(\Rightarrow V=0,5\left(l\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Ba\left(OH\right)2}=0,76\\n_{H2SO4}=0,55\end{matrix}\right.\) ( mol )
\(PTHH:H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)
Thấy ; \(0,55< 0,76\)
\(\Rightarrow n_{BaSO4}=0,55\left(mol\right)\)
\(\Rightarrow m_{kt}=128,15g\)