cho 10.6g hỗn hợp gồm đồng và magie tác dụng với dung dịch axit sunfuric loãng dư sau phản ứng lọc lấy phần chất sắt ko tan cho tác dụng dung dịch axit sunfuric nóng thu được 0.112l khí ở điều khiện tiêu chuẩn tính khối lượng mỗi kim lọa trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Sửa đề: 6,4 gam hh \(\rightarrow\) 6,45 gam hh
a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+27b=6,45\) (1)
Ta có: \(n_{H_2}=\dfrac{7,28}{22,4}=0,325\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,65\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{Mg}=0,1\left(mol\right)\\b=n_{Al}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1\cdot24}{6,4}\cdot100\%=37,5\%\\\%m_{Mg}=62,5\%\end{matrix}\right.\)
b) Ta thấy với 6,45 gam hh thì có 0,1 mol Mg và 0,15 mol Al
\(\Rightarrow\) Trong 12,9 gam hh thì chứa 0,2 mol Mg và 0,3 mol Al
Gọi \(n_{SO_2}=x\left(mol\right)\)
Bảo toàn electron: \(2\cdot0,2+3\cdot0,3=2x\) \(\Rightarrow x=n_{SO_2}=0,65\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,65\cdot22,4=14,56\left(l\right)\)
gọi số mol của Mg là x mol ; Al là y mol => 24x + 27y =6,4
n khí = 7,28/22,4=0,325 mol
bảo toàn e ta có
Mg + H2SO4 --> MgSO4 + H2
x x mol
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
y 3/2 y mol
=> x + 3/2y=0,325
=> x=11/120 mol ; y=7/45 mol
=> mMg11/120*24=2,2g => %mMg = 2,2*100/6,4=34,375%
=>%mAl=100-34,375=65,625%

PTHH:
Cu + H2SO4 ---x--->
Fe + H2SO4 ---> FeSO4 + H2 (1)
2Cu + O2 ---to---> 2CuO (2)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT(1): \(n_{Fe}=n_{H_2}=0,3\left(mol\right)\)
=> \(m_{Fe}=0,3.56=16,8\left(g\right)\)
Ta có: \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
Theo PT(2): \(n_{Cu}=n_{CuO}=0,05\left(mol\right)\)
=> \(m_{Cu}=0,05.64=3,2\left(g\right)\)
=> \(\%_{m_{Cu}}=\dfrac{3,2}{3,2+16,8}.100\%=16\%\)
\(\%_{m_{Fe}}=100\%-16\%=84\%\)

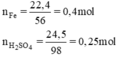
Phương trình hóa học của phản ứng:

So sánh tỉ lệ 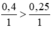 ⇒ Fe dư
⇒ Fe dư
Theo PT nFe (pư) = nH2SO4 = 0,25 mol ⇒ nFe dư = 0,4 – 0,25 = 0,15 mol
mFe dư = 0,15. 56 = 8,4g.
Do khối lượng Fe dư nên tính thể tích khí H2 theo số mol H2SO4.
nH2 = nH2SO4 = 0,25 mol
Vkhí = 0,25 . 22,4 = 5,6l.

a) nFe=0,4(mol); nH2SO4=0,5(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
Ta có: 0,4/1 < 0,5/1
=> Fe hết, H2SO4 dư. tính theo nFe.
=> nH2= nH2SO4(p.ứ)=nFe=0,4(mol)
=>nH2SO4(dư)=0,5-0,4=0,1(mol)
=>H2SO4(dư)=0,1.98=9,8(g)
b) V(H2,dktc)=0,4.22,4=8,96(l)

PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
\(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2\uparrow+2H_2O\)
Ta có: \(n_{SO_2}=\dfrac{0,112}{22,4}=0,005\left(mol\right)=n_{Cu}\)
\(\Rightarrow m_{Cu}=0,005\cdot64=0,32\left(g\right)\) \(\Rightarrow m_{Mg}=10,6-0,32=10,28\left(g\right)\)