Đốt cháy hoàn toàn m gam FeS2 rồi cho toàn bộ sản phẩm khí tạo thành hấp thụ hết vào 200 ml dung dịch Ba(OH)2 0,75M thấy tạo ra 21,7 gam kết tủa. Tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Ta có :
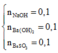
khi đó BTNT.S dễ thấy khi ,thì lượng kết tủa vẫn không thay đổi và vẫn là 21,7 gam.Vì sau khi S chui hết vào NaHSO3 nếu sục tiếp thì SO2 mới hòa tan kết tủa.
Như vậy,đáp án đề bài ra không hợp lý

Đáp án C.
nBa(OH)2= 0,1.2 = 0,2 (mol); nBaSO3 = 0,1 (mol)
nBaSO3 = 2 nBa(OH)2 - nSO2 ⇒ nSO2 = 2.0,2 – 0,1 = 0,3 (mol)
FeS2 → 2SO2 (Bảo toàn S)
0,15 0,3 (mol)
⇒ mFeS2 = 0,15.(56+32.2) = 18 (g)

Chọn đáp án D
sản phẩm cháy gồm C O 2 + H 2 O ; phản ứng với 0,07 mol B a O H 2
► chú ý đun G lại xuất hiện thêm kết tủa nên C O 2 + B a O H 2 → B a C O 3 ↓ + B a H C O 3 2
chính khi đun nóng: B a H C O 3 2 → t 0 B a C O 3 ↓ + C O 2 ↑ + H 2 O
7,88 gam kết tủa ⇄ 0,04 mol B a C O 3 ; tổng có 0,07 mol B a O H 2 → có 0,03 mol B a H C O 3 2
→ bảo toàn nguyên tố C có n C O 2 = n B a C O 3 + 2 n B a H C O 3 2 = 0 , 04 + 0 , 03 × 2 = 0 , 10 m o l
T là este đơn chức, mạch hở, phân tử có chứa hai liên kết pi
→ T có dạng C n H 2 n - 2 O 2
Phản ứng đốt cháy:
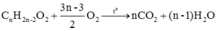
Tỉ lệ n C O 2 : n O 2 = 2 n : 3 n - 3 = 0 , 10 : 0 , 12 → giải ra n = 5.
→ công thức phân tử của T là C 5 H 8 O 2
→ MT = 100.

Đáp án D
4FeS2 +11O2 2Fe2O3 +8SO2
![]()
![]()
Vì cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa nên trong Y có
![]()
Đáp án D

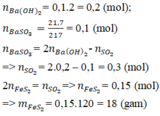

\(n_{BaSO_3}=\dfrac{21.7}{217}=0.1\left(mol\right)\)
\(BTBa:\)
\(n_{Ba\left(HSO_3\right)_2}=0.2\cdot0.75-0.1=0.05\left(mol\right)\)
\(BTS:\)
\(n_{FeS_2}=\dfrac{0.1+0.05\cdot2}{2}=0.1\left(mol\right)\)
\(m_{FeS_2}=0.1\cdot120=12\left(g\right)\)
$n_{Ba(OH)_2} = 0,2.0,75 = 0,15(mol)$
$n_{BaSO_3} = 0,1(mol)$
TH1: $Ba(OH)_2$ dư
Ba(OH)2 + SO2 → BaSO3 + H2O
0,1..............0,1.........0,1........................(mol)
Bảo toàn nguyên tố với S :
$n_{FeS_2} = \dfrac{1}{2}n_{SO_2} = 0,05(mol)$
$m = 0,05.120 = 6(gam)$
TH2 : Có tạo muối axit
Ba(OH)2 + SO2 → BaSO3 + H2O
0,1..............0,1.........0,1........................(mol)
Ba(OH)2 + 2SO2 → Ba(HSO3)2
0,05.............0,1........................................(mol)
$n_{SO_2} = 0,2(mol)$
$n_{FeS_2} = \dfrac{1}{2}n_{SO_2} = 0,1(mol)$
$m = 0,1.120 = 12(gam)$