Hấp thụ hoàn toàn V lít SO2 (đktc) vào 300g dung dịch KOH 5,6%.sau khi p/ứ kết thúc làm bay hơi nước cẩn thận thu được 27,8g muối khan.Tính V.(Tính theo cách có tỉ lệ T ạ)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có: n CO2 = 0,1 mol; n BaCO3= 11,82/197 = 0,06 mol; n K2CO3 = 0,02 mol
Khi sục CO2 vào dung dịch hỗn hợp K2CO3 và KOH, giả sử chỉ xảy ra phản ứng:
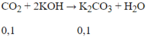
⇒n K2CO3 (trong dd )= 0,1 + 0,02 = 0,12 mol
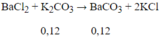
Ta thấy n$ = 0,12 ⇒ n$ đề cho = 0,06 mol
Vậy trong phản ứng CO2 với KOH ngoài muối K2CO3 còn có muối KHCO3
Áp dụng định luật bảo toàn nguyên tố C ta có:
nC(trong CO2) + nC(trong K2CO3) = nC(trong BaCO3) + nC(trong KHCO3)
⇒0,1 + 0,02 = 0,06 + x (x là số mol BaCO3)
⇒x = 0,06

⇒nKOH = 0,14 mol ⇒ [KOH] = 0,14/0,1 = 1,4M

Đáp án D
Ta có: nCO2 = 2,688/22,4 = 0,12 mol;
nBaCO3 = 11,82/197 = 0,06 mol
Do n CO 2 ≠ n BaCO 3 nên ngoài BaCO3 còn có Ba(HCO3)2 được tạo thành.
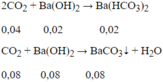
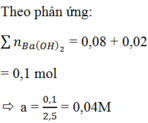

Theo gt ta có: $n_{SO_2}=0,2(mol);n_{KOH}=0,04(mol)$
$KOH+SO_2\rightarrow KHSO_3$
Ta có: $n_{KHSO_3}=0,04(mol)$
$\Rightarrow \%C_{KHSO_3}=2,26\%$
Ta có: \(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(m_{KOH}=200.1,12\%=2,24\left(g\right)\Rightarrow n_{KOH}=\dfrac{2,24}{56}=0,04\left(mol\right)\)
\(\Rightarrow\dfrac{n_{KOH}}{n_{SO_2}}=0,2< 1\)
Vậy: Pư tạo muối KHSO3.
PT: \(SO_2+KOH\rightarrow KHSO_3\)
__________0,04______0,04 (mol)
Có: m dd sau pư = 0,2.64 + 200 = 212,8 (g)
\(\Rightarrow C\%_{KHSO_3}=\dfrac{0,04.120}{212,8}.100\%\approx2,26\%\)
Bạn tham khảo nhé!

Đáp án C
Pt pư:
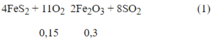
Ta có: nBaC03 = 0,15 mol
nKOH = 0,1 mol ⇒ nBa2+ = 0,15 mol ; nOH- = 0,4 mol
Khi cho SO2 vào dung dịch Y thu được 21,7 (g) BaSO3. Cho Y tác dụng với dung dịch NaOH thấy xuất hiện thêm kết tủa, chứng tỏ trong dung dịch Y có ion HSO3-.
Vì: Ba2+ + HSO3- + OH- " BaSO3 + H2O
Ta có: nBaC03 = 0,1 mol
Ptpứ:
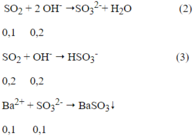
Ta có: nOH- = 0,4 - 0,2 = 0,2 mol
Theo ptpư (2), (3) ta có: n SO2= 0,1 + 0,2 = 0,3 mol
Theo ptpư (1) ta có: n FeS2 = ½ n SO2= 0,15 mol ⇒ m FeS2 = 120.0,15 = 18(g)
\(m_{KOH}=300\cdot5.6\%=16.8\left(g\right)\)
\(n_{KOH}=\dfrac{16.8}{56}=0.3\left(mol\right)\)
Giả sử : Muối chỉ có K2SO3
\(n_{K_2SO_3}=\dfrac{0.3}{2}=0.15\left(mol\right)\)
\(m_{K_2SO_3}=0.15\cdot158=23.7< 27.8\left(g\right)\)
=> Phản ứng sinh ra 2 muôi
\(n_{K_2SO_3}=a\left(mol\right),n_{KHSO_3}=b\left(mol\right)\)
\(2KOH+SO_2\rightarrow K_2SO_3+H_2O\)
\(KOH+SO_2\rightarrow KHSO_3\)
\(\left\{{}\begin{matrix}2a+b=0.3\\158a+120b=27.8\end{matrix}\right.\)
\(\Rightarrow a=b=0.1\)
\(V_{SO_2}=0.2\cdot22.4=4.48\left(l\right)\)
$n_{KOH} = \dfrac{300.5,6\%}{56} = 0,3(mol)$
Giả sử muối chỉ có $K_2SO_3$
$2KOH + SO_2 \to K_2SO_3 + H_2O$
$n_{K_2SO_3} = \dfrac{1}{2}n_{KOH} = 0,15(mol)$
$m_{K_2SO_3} = 0,15.158 = 23,7(gam) < 27,8$
$\to$ Loại
Giả sử muối có $KHSO_3$
$KOH + SO_2 \to KHSO_3$
$n_{KHSO_3} = n_{KOH} = 0,3(mol)$
$m_{KHSO_3} = 0,3.120 = 36 > 27,8$
$\to$ Loại
Vậy muối gồm $K_2SO_3(a\ mol) ; KHSO_3(b\ mol)$
Ta có :
$158a + 120b = 27,8$
$2a + b = 0,3$
Suy ra a = b = 0,1
$n_{SO_2} = a + b = 0,2(mol)$
$V_{SO_2} = 0,2.22,4 = 4,48(lít)$